干细胞是一种具有多向分化潜能的成体干细胞, 它不仅能促进损伤组织的再生与修复, 还拥有良好的免疫调节能力, 通过调控免疫细胞的增殖、分化和功能状态, 调节炎症因子水平, 对于各种炎症相关疾病具有很好的应用前景。
先来张图看看干细胞的神奇特质:
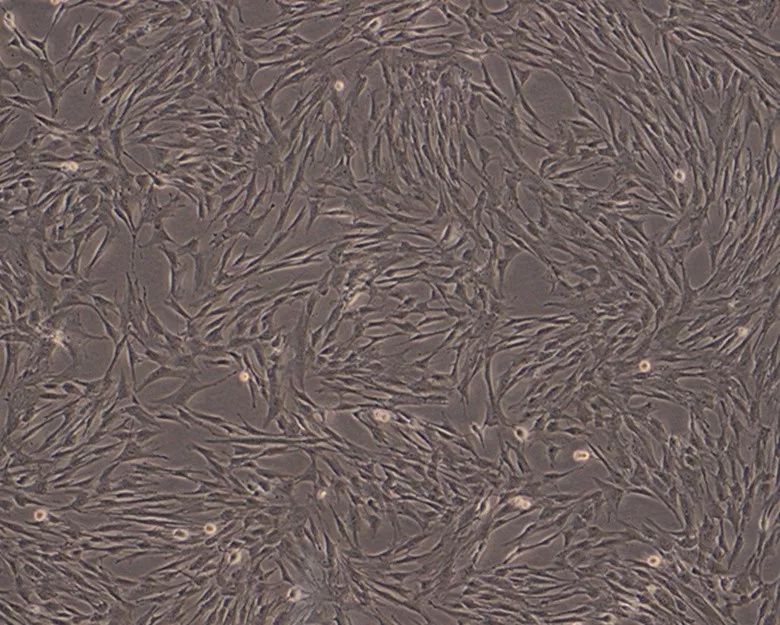
体外培养的干细胞迅速增值,并争先恐后地去抢占地盘,这种“定向迁移”的能力,对损伤修复至关重要:
国际治疗协会将干细胞定义为:
(2)表达基质细胞的表面抗原, 但不表达造血细胞表面抗原;
(3)具有向成骨细胞、脂肪细胞以及软骨细胞分化的潜能。干细胞除了因很强的自我更新能力及多向分化潜能而具有促进损伤组织再生修复的能力外, 它对机体的免疫功能也具有很强的调控作用, 主要表现为通过影响免疫细胞的增殖、分化和免疫因子分泌而抑制免疫反应, 因此,干细胞显示出较强的抗炎能力。
干细胞在免疫调节中的意义
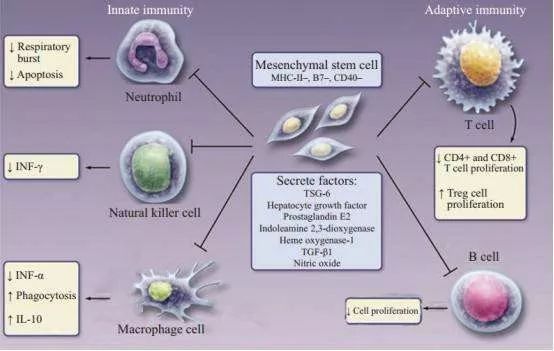
干细胞是一种免疫豁免细胞, 能够抑制先天免疫(中性粒细胞、巨噬细胞和NK细胞)和获得性免疫(T细胞和B细胞)。
干细胞可以分泌一种被称为hCAP-18/LL37具有抗菌作用的抗菌肽。
干细胞的免疫调节作用
大量研究证实,干细胞可以通过旁分泌机制以及干细胞与免疫细胞间的相互作用, 介导调节免疫反应平衡, 最终促使局部炎症反应下调, 减轻组织炎症损伤。干细胞对炎症免疫反应的调节主要包括对先天免疫和获得性免疫反应的调节。
干细胞在体内外均能调节不同免疫细胞增殖、功能状态及表型的转化, 尽管干细胞潜在的免疫抑制机制尚不十分清楚, 但是许多研究已经证实干细胞的生物学作用, 预示了良好的应用前景。
干细胞对主要脏器的炎症损伤的修复
免疫炎症反应对于组织再生是不利的因素, 尽管炎症可能加速修复反应, 带来的负面效应却是纤维化形成, 阻碍再生。因此, 减轻损伤脏器的炎症反应程度,可以减轻纤维化修复, 有利于组织向再生修复发展。
干细胞在炎性关节炎中的应用
类风湿关节炎( rheumatoid arthritis,RA):RA是一种常见的以慢性、对称性进行性滑膜炎为主要表现的炎性关节炎,最终导致骨和软骨破坏。 Jones等在研究中发现,RA患者滑膜干细胞的数目、体外增殖能力以及软骨分化能力均明显下降,提示RA患者的滑膜炎不仅导致骨和软骨破坏,同时损伤了关节固有的软骨再生能力。干细胞兼具软骨分化及免疫调节特性使其成为治疗RA的希望。研究中发现同种异体来源干细胞和干细胞诱导分化的软骨细胞能够在体外呈剂量依赖性抑制Ⅱ型胶原诱导的RA患者外周血和(或)关节液的T细胞增殖反应,并抑制炎性细胞因子干扰素y和TNF的产生,促进抗炎因子4和IL10的分泌,显示了干细胞治疗RA的应用前景。另一项关于干细胞的体外研究证实,同种异体来源干细胞呈剂量依赖性抑制RA患者外周血T细胞增殖,降低炎性细胞因子干扰素-y、TNFa和L17的分泌,增加抗炎因子Ⅱ10的释放,并促进调节性T细胞亚群的分化;不仅如此,干细胞还能够抑制RA患者成纤维细跑样滑膜细胞炎症细胞因子的释放,减少基质降解酶的产生。
干细胞在骨关节炎中的应用
骨关节炎是一种退行性骨关节疾病,主要表现为关节软骨进行性消失,骨质过度增生。骨关节炎发病与衰老、肥胖、创伤、炎症、遗传等多因素相关。由于关节软骨的再生修复能力有限,临床上又缺乏有效促进软骨修复的治疗方法,目前骨关节炎治疗以减轻症状为主。近年对于干细胞的多向分化潜力及抗炎特性的逐步深入了解,使得干细胞成为有效控制骨关节炎的希望。实验利用两性霉素B注入驴的双侧腕关节诱导骨关节炎模型,造模成功后右腕关节注入悬浮于3m1透明质酸的(1.8~2.3)×10%mlMsCs,腕关节注射相同体积透明质酸作为对照组,实验结果显示干细胞关节腔注射不仅能够改善骨关节炎症状,而且能够延缓骨关节炎的放射学进展,促进关节软骨修复。单次关节腔注射1×10个同种异体来源干细胞治疗兔的骨关节炎模型,治疗后8周放射学及组织学检查显示干细胞治疗能够延缓骨关节炎的进展。

干细胞在脊柱关节炎中的作用
( spondyloarthritis.,spA):SpA是一组相互关联的系统疾病,包括强直性脊柱炎( ankylosing spondylitis,AS)、反应性关节炎、银屑病关节炎、炎性肠病相关性关节炎等。其发病均与HLAB27具有不同程度的相关性。HLA-B27诱发SpA发病的确切机制未明,可能是HLAB27游离重链在内质网发生错误折叠,激发未折叠蛋白反应,活化CD4+Th细胞,导致IL-17等前炎性细胞因子的释放,或游离重链在抗原递呈细胞表面形成同源二聚体,与KIR3DL2CD4T细胞结合,促进后者的存活、增殖及释放炎症细胞因子。在B27诱发SpA发病过程中,自身免疫功能紊乱起重要作用,而干细胞免疫调节作用异常可能参与这一过程的发生。实验发现AS患者骨髓来源干细胞的免疫调节作用显著低于健康人,异常的干细胞导致初始CD4Th细胞向Th17分化,调节性T细胞数目减少,干细胞兔疫调节作用异常可能是AS发病的始动因素,而健康同种异体来源的干细胞具有一定的治疗作用。研究中发现干细胞能够抑制脐带血初始CD4Th细胞向Th17分化,并抑制Th17细胞产生L17、22等前炎性细胞因子,促进Th7表达转录因子FOXP3,使其具有调节性T细胞表型。另有学者在研究中证实干细胞抑制小鼠腹膜活化巨噬细胞等炎性细胞因子的释放。健康同种异体来源干细胞对SpA关键致病因子17、TNFa的抑制作用,以及促进调节性T细胞分化的能力使其在SPA临床治疗中颇具前景。
干细胞与脊髓损伤的修复
在脊髓损伤实验中, 干细胞能显著减轻实验性脊髓损伤的慢性炎症和损伤所致的机械刺激高敏感性, 并且证实干细胞对于感觉运动功能的增强作用至少有部分是通过其抗炎/免疫抑制作用来实现的。长期高压氧(hyperbaric oxygen, HBO)能够促进缺血性卒中的神经发生, 同时抑制其炎症反应。对于神经损伤后的干细胞移植, 干细胞不仅能直接促进损伤局部的再生修复,而且还能通过减轻局部的炎症反应,减轻炎性损伤, 同时减少纤维化形成。
干细胞治疗哮喘
研究发现骨髓干细胞, 能明显减少支气管肺泡灌洗液和气道中的嗜酸性粒细胞以及单核细胞的数量, 增加IL-10及IL-12水平, 并且小鼠气道杯状细胞的增生以及对于乙酰胆碱的反应性均有明显的下降, 同时上调肺淋巴结中CD4+CD25+调节性T细胞的数量。显然, 骨髓干细胞气管内移植能够显著减轻哮喘的气道炎症反应,控制免疫反应程度以减轻肺部炎性损伤, 从而提高了肺功能。
由于干细胞所具有的免疫抑制效应, 使得它在慢性哮喘的气道重塑和气道炎症治疗中也表现出抑制炎症的作用。因此,干细胞移植有望在多种肺脏炎性疾病的治疗发挥作用。
干细胞与肾损伤
干细胞治疗组小鼠血清肌酸酐水平明显降低, 并且明显改善了肾脏的功能。 干细胞治疗组在24 h时肾脏组织再生与对照组相比明显加快。同时, 治疗组Bcl-2/Bad的比例在24 h和48 h也明显升高了。所以提示, 干细胞的免疫调节能力发生在早期, 主要是通过改变炎症因子谱向Th2分泌谱变化来实现的。研究发现,通过移植TK-干细胞可以有效地保护受损肾脏, 表现在血尿素氮、血清肌酐水平以及肾小管损害的下降。病理观察发现, 肾脏间质中性粒细胞和单核/巨噬细胞的渗入明显减少, 同时降低了髓过氧化物酶MPO的活性、过氧化物的形成、p38细胞分裂素活化蛋白激酶的磷酸化以及TNF-α、单核细胞化学吸引蛋白质1和胞间黏附分子1的表达, 由此表明, TK-干细胞能显著减轻肾脏组织内的炎症反应程度。
干细胞与脑急、慢性损伤的修复
外伤性脑损伤(traumatic brain injury, TBI)是目前世界上造成残疾和死亡的主要原因之一。有研究发现尾静脉注射MSCsCXCR4至小鼠TBI模型, 更多的干细胞趋化至大脑损伤部位, 同时还激活了干细胞的Akt信号通路, 促进其分泌更多的细胞因子和生长因子, 促进了TBI边缘部位血管生成和神经保护。
前瞻性临床试验发现, 通过腰椎穿刺输注人干细胞6个月后可以明显改善TBI后遗症患者的Fugl-Meyer评分(Fugl-Meyer assessments, FMA)和功能独立自主量表评分(functional independence measures, FIM), 表现在运动、感觉和自我意识等大脑功能的恢复。

干细胞因其免疫调节及多向分化的特性,越来越受到医学界的重视,同时干细胞易于从不同组织中获取并且具有良好的体外扩增能力, 使得其在组织损伤炎症与修复的临床运用中具有广阔的前景。 干细胞在许多疾病的治疗中表现出了它的优越性, 特别是对于免疫调节失衡导致的炎症性相关疾病的治疗中表现出良好的效果。此外, 通过发挥其组织修复作用还能加速由于创伤等原因导致的组织损伤。相信在细胞生物治疗领域, 干细胞将占有重要的地位。
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论