细胞疗法是目前临床前和临床环境中研究最多的治疗方式之一,许多细胞治疗产品已获得批准。截止2022年初,全球经批准的细胞治疗产品共33款,包括12种免疫细胞和21种干细胞。值得注意的是,许多已经批准的细胞疗法正在开发新的适应症。
下文,我们将分别介绍已经获得各国监管机构批准上市的细胞治疗产品。
-01-
全球临床批准的细胞产品
免疫细胞,目前只有T细胞和DC产品被批准上市。其中大多数 T 细胞产品是用于血液系统恶性肿瘤的CAR-T疗法,而 DC 产品是用于治疗实体肿瘤的疫苗。
临床批准的免疫细胞产品
目前,全球范围内共批准了9种T细胞相关产品,其中美国FDA批准上市6 款CAR-T 产品,中国NMPA批准上市2款CAR-T产品。有意思的是,韩国KFDA批准上市1款CIK产品。
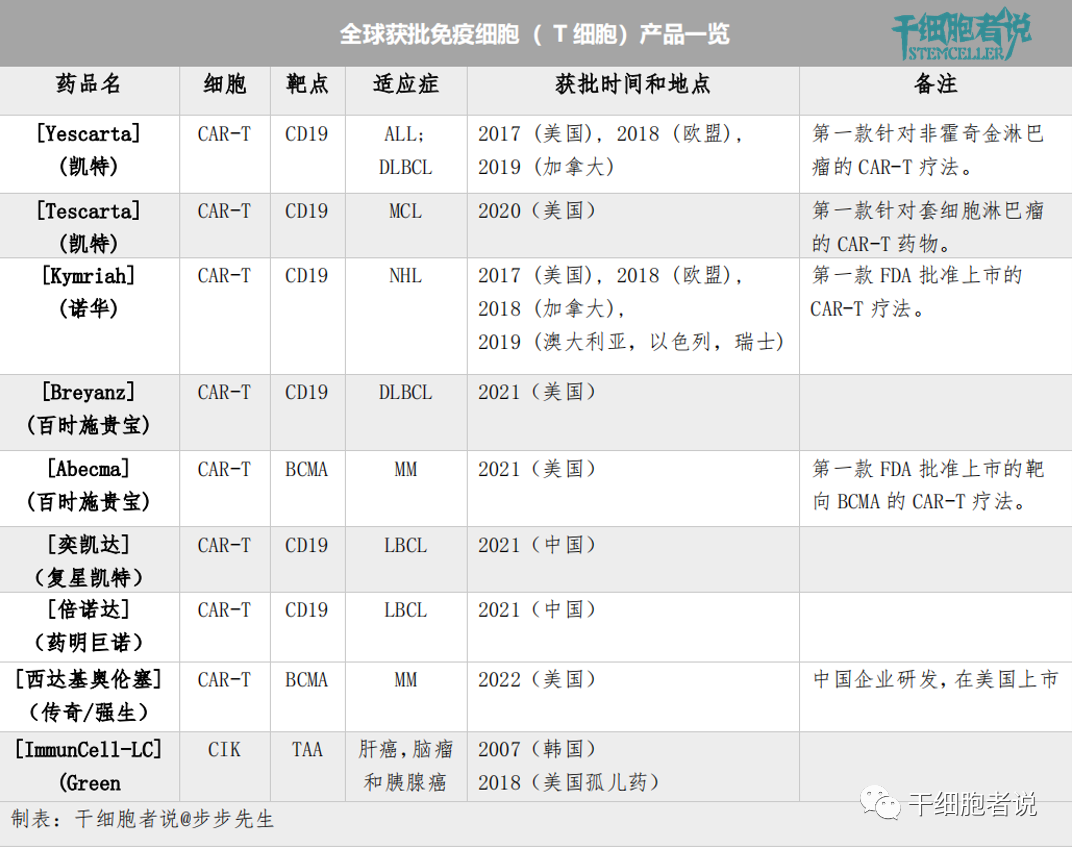
各国获批免疫细胞( T 细胞)一览
CAR的两个基本部分包括用于识别癌细胞表面抗原的细胞外靶点结合域和细胞内信号部分,由共同刺激和激活域组成,启动包括激活、扩增和细胞杀伤在内的过程。值得注意的是,所有经批准的CAR-T产品都是自体的,并且含有靶向CD19的CAR(CD19是B细胞表面标记物)。
目前全球市场上共有8种CAR-T产品获上市批准。2017年,美国FDA批准全球第一款CAR-T细胞疗法Kymriah。Kymriah适用于复发性、难治型以及青少年B细胞急性淋巴性白血病(ALL) ,主要用于青少年、儿童患者。
2020年,第三款CAR-T产品Tecartus获得美国FDA批准。Tecartus适用于治疗成人r/r套细胞淋巴瘤(MCL),这是一种侵袭性、罕见的非霍奇金淋巴瘤。Tecartus制备过程包括一个丰富T细胞群的步骤,并从患者外周血单个核细胞(PBMC)中去除循环肿瘤细胞(CTC)。目的是防止CAR-T细胞在体外制备过程中活化和随后耗尽。
目前全球市场上只有1种CIK产品获上市批准。ImmunCell-LC是一种自体细胞因子诱导杀伤 (CIK)细胞疗法,在2007 年获得韩国KFDA 批准,并在2018年获得美国FDA孤儿药称号。它被用作肝细胞癌、脑肿瘤和胰腺癌切除后的辅助治疗,通过清除残余肿瘤细胞实现治疗。ImmunCell-LC的制备,通过分离外周血单个核细胞(PBMC),然后用IL-2和抗CD3抗体一起刺激培养,最后得到活化的混合的一群异质性T细胞。
3. DC细胞
目前全球市场上共有3种DC产品获上市批准。DC 疫苗是免疫细胞治疗另一个活跃领域,主要采用自体细胞。
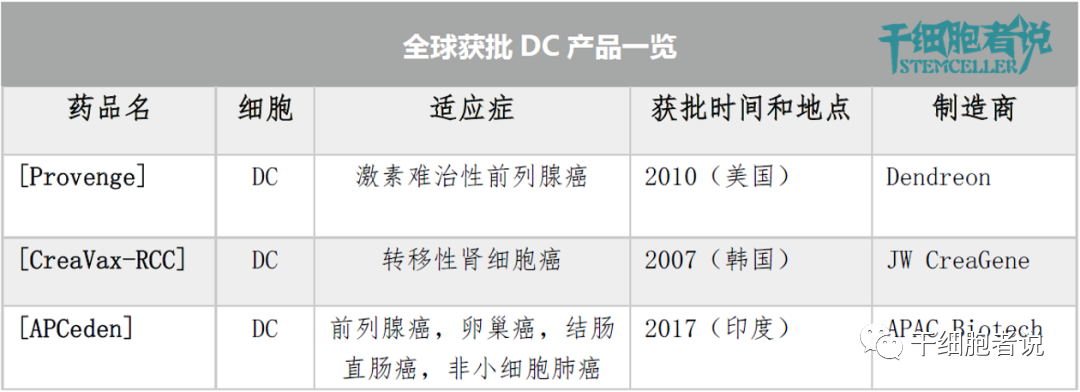
各国获批DC产品一览
2010年,Provenge获得美国FDA批准,用于治疗激素难治性前列腺癌。Provenge是美国FDA批准的第一个DC疗法,也是FDA批准的唯一的DC疗法。
Provenge制备:
收集患者的外周血单个核细胞(PBMC),然后用前列腺特异性癌相关抗原(PAP)和GM-CSF进行体外扩增获得。
Provenge疗程:
Provenge是由DC为主的多细胞悬浮液,分3次静脉注射,每次间隔2周。
Provenge作用机制:
作用机制是DC介导的PAP向患者T细胞呈递,引发针对前列腺癌细胞的适应性免疫反应。
2007年,自体DC疗法CreaVax被韩国KFDA批准,用于肾细胞癌的治疗。2017年,自体DC疗法APCeden被印度CDSCO批准,用于治疗前列腺癌、卵巢癌、结直肠癌和非小细胞肺癌等疾病的治疗。
临床批准的干细胞产品
截至目前,全球共有21种干细胞产品已在全球获得批准,其中12种获得美国FDA或欧洲EMA的批准。其余9种产品主要在亚洲获得批准。值得注意的是,获批产品主要是由造血干细胞或间充质干细胞组成。另外,还有一个角膜缘干细胞产品。
1. 造血干细胞(HSC)
目前全球批准的造血干细胞疗法共有 10 种。其中美国FDA批准 8 种脐血产品,均用于造血干细胞移植的治疗。欧盟EMA 批准 2 种基于自体造血干细胞的基因疗法,Strimvelis 用于腺苷脱氨酶缺乏症(ADA-SCID),Zynteglo 用于治疗输血依赖性地中海贫血症。
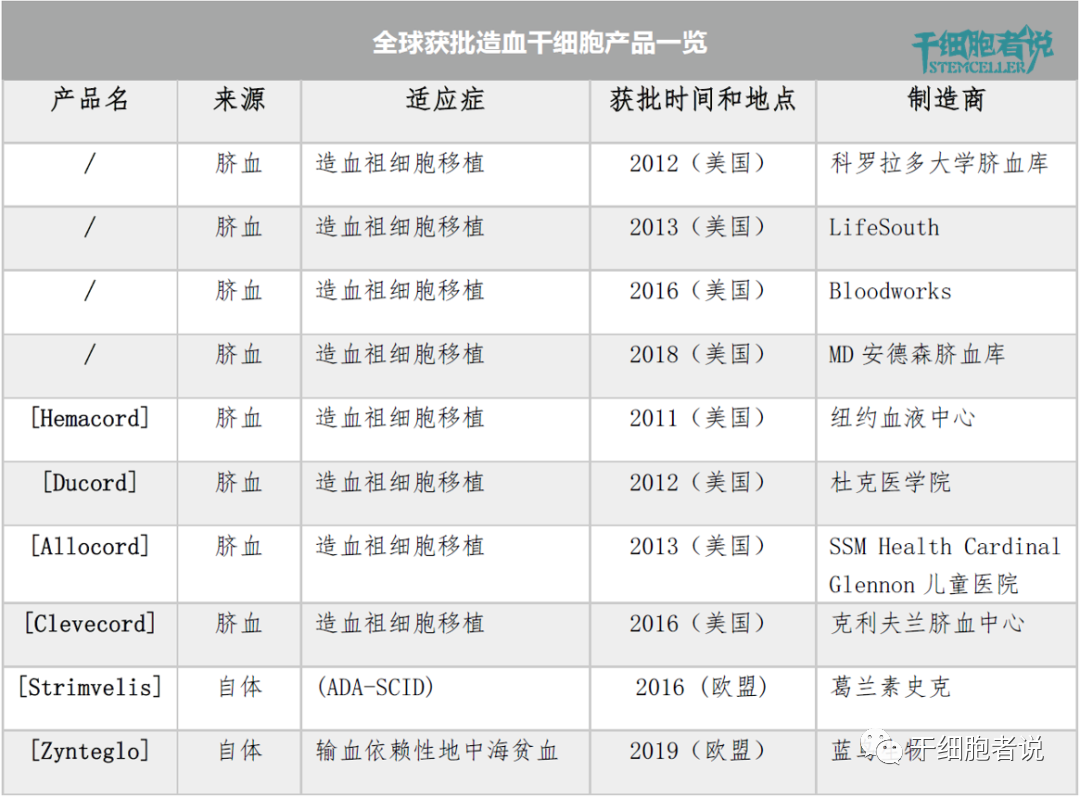
各国获批造血干细胞产品一览
脐血造血干细胞比其他来源(如骨髓,外周血)的异体造血干细胞更有优势。因为脐血获得更容易,对人类白细胞抗原(HLA)的耐受性更高错配,GVHD的风险较低。
此外,Strimvelis和Zynteglo均是EMA批准的基于自体造血干细胞的基因疗法。
2016年,EMA批准Strimveli,适用于腺苷脱氨酶缺乏症(ADA-SCID),一种由腺苷脱氨酶(ADA)基因编码突变引起的免疫缺陷疾病。
2019年,EMA批准Zyntegl, 适用于治疗输血依赖性地中海贫血,这是一种由β-珠蛋白基因突变引起的遗传性疾病,导致成人血红蛋白显著减少或缺失。
2. 间充质干细胞(MSCs)
目前全球批准的间充质干细胞产品共有 10 种,但没有一款获得美国FDA 的批准。根据作用机制和批准的适应症,MSCs产品可分为两大类:组织修复和免疫调节。
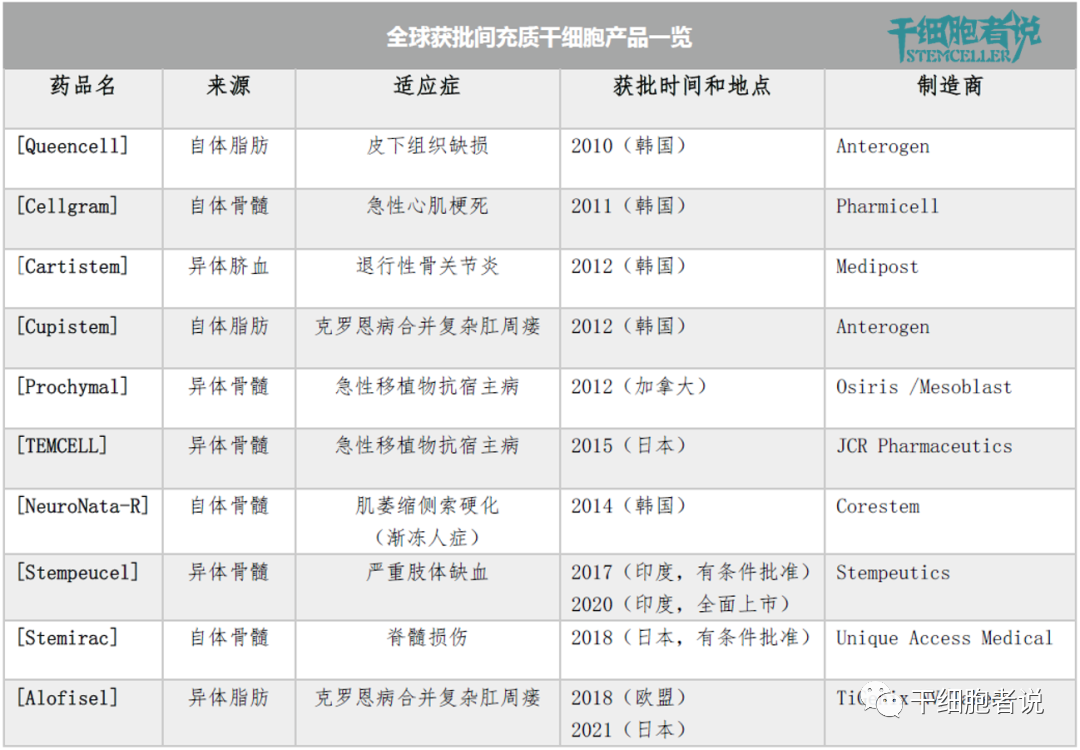
各国获批间充质干细胞产品一览
其中,有三种MSCs产品已被批准用于组织修复应用。
2011年,韩国KFDA批准基于MSCs的组织修复产品Cellgram, 适用于治疗急性心肌梗死。
2012年,韩国KFDA批准另一种基于MSCs的组织修复产品Cartistem,适用于重复性和/或创伤性软骨退行性病变,包括退行性骨关节炎。
2010年,韩国KFDA批准一种自体脂肪来源的细胞产品Queencell,适用于皮下组织缺损的治疗。不过,Queencell并非由单一MSCs组成,而是由MSCs、周细胞、肥大细胞、成纤维细胞和内皮祖细胞的混合细胞组成,类似于SVF。
MSCs具有免疫调节功能,可用于调节多种疾病的免疫反应。其中,七种MSCs产品已被批准,适应症包括克罗恩病(Alofisel、Cupistem)、急性移植物抗宿主病(Prochymal、TEMCELL)、肌萎缩侧索硬化(NeuroNata-R)、脊髓损伤(Stemirac)和Buerger病引起的严重肢体缺血(Stempeucel)。
Alofisel,一种异体脂肪来源MSCs产品。EMA批准的唯一MSCs产品,适应症是克罗恩病复杂肛周瘘。作用机制主要是MSCs抑制活化淋巴细胞增殖从而减少促炎细胞因子产生。
Cupistem,一种自体脂肪来源MSCs产品。2012年获得韩国KFDA批准,适应症是克罗恩病复杂肛周瘘。
Prochymal,一种异体骨髓来源MSCs产品。2012年获得加拿大CFIA批准,适应症是儿童类固醇难治性急性GVHD。
值得注意的是,在3期临床试验中,Prochymal在SR-aGvHD儿童患者首次类固醇治疗失败后使用,显示了作为一线治疗的安全性、耐受性和有效性。然而,FDA拒绝批准,FDA给出的理由是试验数据来自单臂试验而不是随机试验,建议至少再做一次随机试验的数据。
其中一些MSCs产品(例如Cellgram, Cartistem、Prochymal)正在当前临床试验中评估其他适应症,包括酒精性肝硬化、COVID-19引起的急性呼吸窘迫综合征(ARDS)和软骨损伤。
除了已经批准的造血干细胞和MSCs产品外,还有1款角膜缘干细胞(LSC)产品也获批。2015年,欧盟EMA批准Holoclar,用于治疗眼部烧伤引起的角膜干细胞缺乏症。但是,由于Holoclar以角膜片而非单细胞悬浮液的给药方式,我们暂时不讨论。
其他细胞疗法
1. 红细胞和血小板
血液制品在治疗血液疾病和缺陷方面有着悠久的历史,但目前并没有针对红细胞和血小板的特定经批准的产品。
红细胞疗法适用于治疗因血液疾病(即地中海贫血、镰状细胞病、铁或其他维生素缺乏、再生障碍性贫血)而引起的贫血症。静脉注射前,血液必须进行ABO血型和RhD匹配。最常用的是红细胞输注,但也可以输注全血。
血小板输注用于治疗血栓血细胞减少症(疾病或癌症治疗引起)。血小板的最佳储存条件和给药方案是目前研究的方向。
2. 微生物疗法
目前,国际上并没有批准任何一种临床使用的微生物药物,但临床上使用相关的疗法。第一种是粪便菌群移植(FMT),其中健康捐赠者的粪便溶液被供应到患者的肠道,以改变肠道微生物组组成。虽然可用于临床治疗,但并没有作为药品开发的。第二种是益生菌,包括在非处方药中广泛使用的活菌群,也可由临床医生处方。通常被归类为食品、功能性食品或补充剂,因此也不作为药物监管处理。
-02-
小结与问题
最后回顾一下,全球经批准细胞治疗产品共有的33款,包括12种免疫细胞(CAR-T细胞8种,DC细胞3种,CIK细胞1种)和21种干细胞(脐血造血干细胞10种,间充质干细胞10种,角膜缘干细胞1种)。值得一提的是,红细胞和血小板,还有微生物疗法,虽然可用于临床治疗,但并没有一款作为药品开发和监管的。
总体来看,干细胞治疗正如雨后春笋般兴起,为诸多难治性疾病提供了一条有效治疗途径。从早期对细胞疗法的质疑,到现在似乎又重新变成一个充满活力的新兴行业。
目前,中国对细胞治疗分别按药品注册和医疗技术进行“类双轨制”监管。按药品注册开展临床试验,由国家药品监督管理局(NMPA)监管,最终可上市销售;按医疗技术开展临床研究,由卫健委监管,最终经备案通过后进行临床研究获得试验数据,但目前尚未有明确的临床转化途径(即收费)。
参考文献
Wang LL, Anselmo AC, Mitragotri S, etc. Cell therapies in the clinic. Bioeng Transl Med. 2021
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论