脑卒中是一种突发性脑血液循环障碍,发病迅速,发病率和死亡率都很高[1]。伴随着人口老龄化,预计中风患病率将逐渐增加 [2]。因此,脑卒中的预防和后遗症的治疗已成为亟待关注的科学问题。
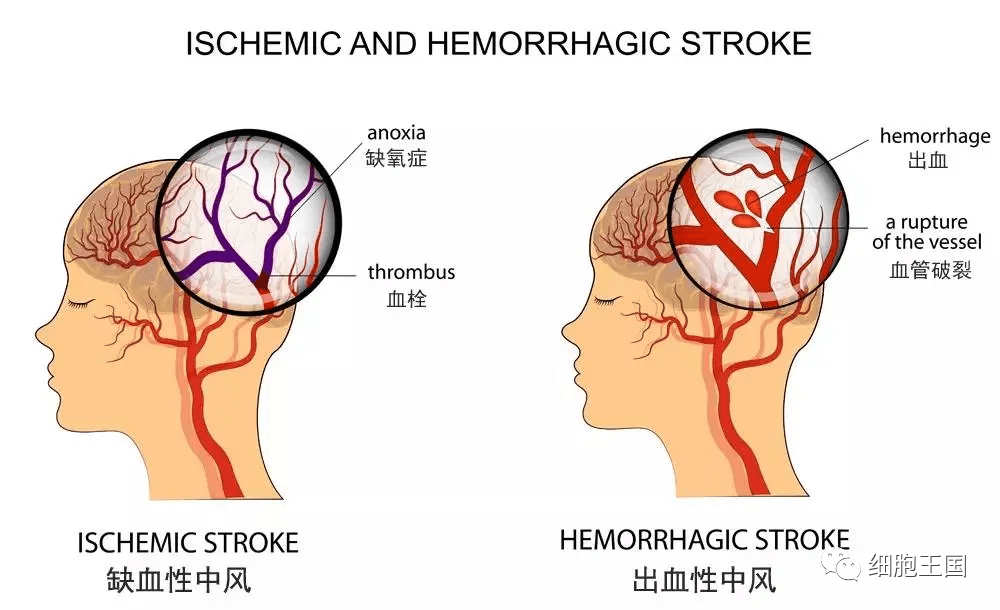
中风可分为缺血性中风和出血性中风。缺血性中风是由血管阻塞导致流向大脑特定区域的血流减少。出血性中风是由脑部血管破裂引起的,导致脑部或蛛网膜下腔出血 [2,3]。
为了治疗中风,已有多个研究证实可以使用间充质干细胞 (MSCs) 的移植,因为它们具有发挥治疗作用的内在能力。间充质干细胞是多能干细胞,具有较高的自我更新能力和多向分化潜能,在一定的诱导条件下能够分化为脂肪细胞、软骨细胞、成骨细胞、神经元和胶质细胞[4,5,6,7]。最常研究的 MSCs 是脂肪来源的间充质干细胞 (ADSCs) 和骨髓来源的间充质干细胞 (BMSCs)以及脐带间充质干细胞(UC-MSCs) [8]。根据细胞来源,不同的给药时机可能会导致不同的治疗效果[13]。
近日刊载于国际分子科学杂志上的一篇综述,较为全面的阐述了间充质干细胞治疗中风的益处。

目前来看,间充质干细胞有以下几种移植方法,包括脑内注射 (IC)、脑池内/脑室内注射(ICV)、鼻内递送(IN) [14]和血管内递送途径,例如静脉注射(IV) 或动脉内输注(IA)。IV和IC是动物和临床研究中使用最广泛的递送方法。尽管静脉注射操作简单,并且比脑内注射更适用于大面积梗塞,但实际上很少有细胞可以到达目标区域。另一方面,脑内注射可以直接将药物输送到损伤部位,但注射一定量的液体会导致颅内高压升高,进针可能会直接造成神经损伤和功能性病变[13](图1)。
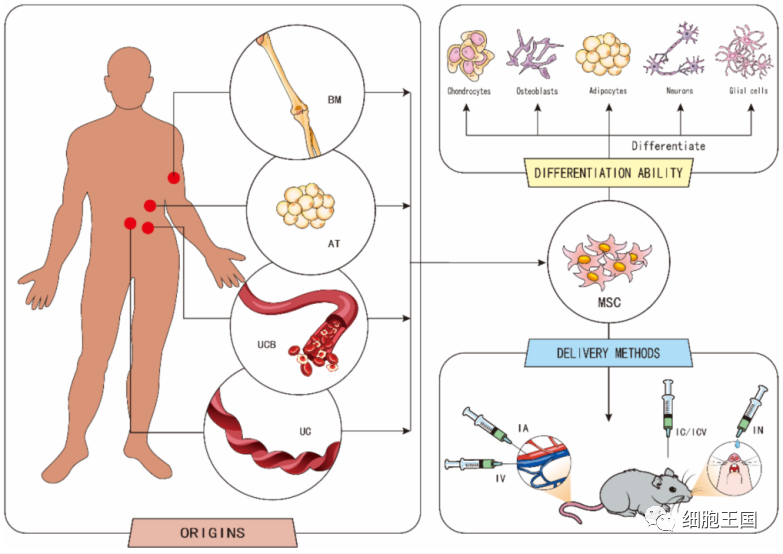
间充质干细胞 (MSCs) 的起源、分化能力和传递方式。
01 MSC治疗中风的机制
值得注意的是,在中风发作时给予的治疗通常旨在减少损伤,而在中风后数天至数周开始的治疗往往会促进修复。以下部分将根据最近的研究说明MSCs的机制和参与中风治疗的主要蛋白质。它们通过免疫调节减轻炎症、释放营养因子和分泌细胞外囊泡 (EV)以促进治疗效果、诱导血管生成、促进神经再生、减少梗塞体积、替换受损细胞。
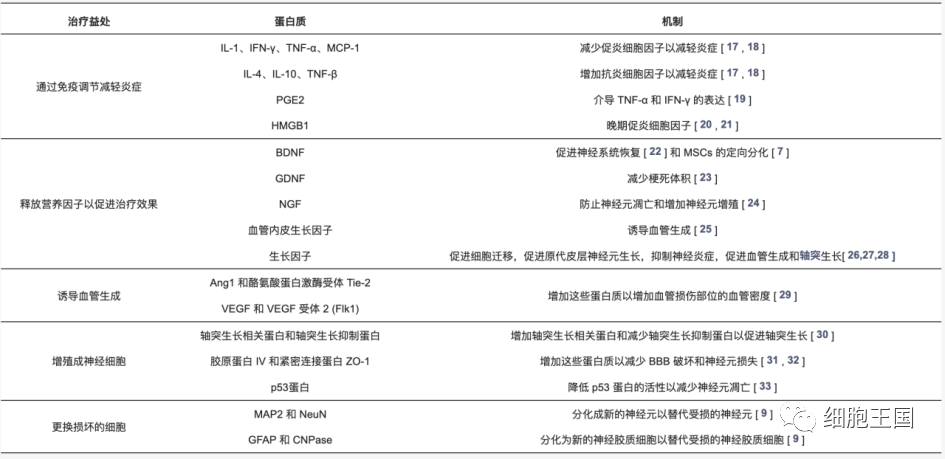
参与 MSCs 治疗机制的蛋白质。
免疫调节减轻炎症
中风后,小胶质细胞从静止状态转变为活化状态,并采用吞噬表型分泌促炎细胞因子 [34]。当MSC被移植到动物模型中时,它们会产生炎症介质并影响细胞因子的表达 [16]。一方面,MSCs可以增加抗炎细胞因子的分泌,如白细胞介素4(IL-4)、白细胞介素10(IL-10)和肿瘤坏死因子β(TNF-β)。另一方面,间充质干细胞可以降低促炎细胞因子的表达,包括白细胞介素-1(IL-1)、干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)和膜辅因子蛋白-1 (MCP-1) [17,18]。通过调节这些细胞因子,MSCs 影响了涉及免疫细胞和免疫反应的几种途径,以减少炎症 [35]。
基于对中风的大量动物研究证实,间充质干细胞可以通过分泌多种免疫因子调节免疫反应发挥抗炎作用,这些调节机制可作为潜在的治疗途径。
释放营养因子以促进治疗效果
间充质干细胞释放或刺激释放与中风治疗机制相关的营养因子。这些营养因子不仅包括脑源性神经营养因子(BDNF)和胶质细胞源性神经营养因子(GDNF)等神经营养因子,还包括神经生长因子(NGF)、血管内皮生长因子等生长因子。( VEGF) 和血小板衍生生长因子 (PDGF)。
MSCs分泌的这些营养因子可以减少梗死体积,防止神经元凋亡,增加神经元增殖,诱导血管生成。移植后,间充质干细胞从病灶外的血管系统迁移到梗死区域,通过分泌BDNF来减少梗死体积[22]。
值得注意的是,MSCs释放的这些营养因子的多少与MSCs培养的传代、MSCs的来源等影响因素有关。在大鼠中风模型中,体外培养的人MSCs在体外、早期传代或后期传代中的应用表明,接受早期传代MSCs的大鼠的行为恢复和神经发生比接受后期传代MSCs的大鼠更明显。这主要是因为MSC分泌的营养因子,如 GDNF、NGF 和 VEGF,在早期 MSC 处理的大脑中明显高于后期 MSC 处理的大脑 [39]。此外,间充质干细胞的来源也影响其治疗特性,特别是考虑到 ADSCs 分泌的 VEGF 量显著高于BMSCs [9]。
总之,间充质干细胞通过分泌多种营养因子发挥多种治疗作用。未来,基因修饰可能是主要研究方向,以研究如何增强间充质干细胞的治疗效果。除了修饰单个基因外,还可以将几个具有相似作用的基因一起修饰,以研究治疗效果[40]。
诱导血管生成
MSCs移植后,血管生成素的表达和缺血性脑组织的血管密度明显增加。在受损血管中,MSCs 显示出与血管生成和动脉密度相关的多种因子的高表达,如血管生成素-1 (Ang1)、酪氨酸蛋白激酶受体 (Tie2)、VEGF 和 VEGF 受体 2 (Flk1) . Tie2是Ang1的受体,Flk1是VEGF的受体。
为此,MSCs在脑卒中的治疗中具有促血管生成作用,主要是通过促进生长因子分泌和结合趋化因子的机制。
促进神经再生
MSC移植可以促进神经再生的第一种方式涉及增强内源性神经细胞的增殖。简而言之,缺血边界区 (IBZ) 的神经可塑性和神经增殖增强是MSC治疗可导致卒中后功能恢复的机制之一。MSC治疗后,梗死区域周围的BrdU (+) 细胞显著增加,这可能表明更多的细胞增殖 [44]。
事实上,间充质干细胞促进了IBZ的轴突、突触和髓鞘的生长,从而改善了神经功能。MSCs 显著增加了初级皮层神经元的轴突生长 [45]。对中风小鼠进行MSC治疗后,轴突生长相关蛋白的表达显著增加,轴突生长抑制蛋白的表达显著降低 [30]。在促进中风后突触可塑性方面 [46],MSC 产生的外泌体 (Exos) 治疗增加了IBZ突触素,从而增加了突触重塑和突触可塑性[47]。
此外,MSCs可以诱导髓鞘形成。在诱导髓鞘形成方面,在接受 MSC 产生的 Exos 治疗的大鼠的 IBZ 中,少突胶质细胞和少突胶质祖细胞的数量有所增加。少突胶质细胞有助于促进髓鞘生长和保护髓鞘免受损伤 [48]。
静脉注射的MSCs 改善了血脑屏障 (BBB) 的神经功能恢复。在这种情况下,MSCs 增加了脑出血大鼠受损大脑中胶原蛋白 IV 的表达水平和紧密连接蛋白 zonula occludens-1 (ZO-1) 的表达水平,以减少 BBB 破坏和神经元丢失 [31, 32]。
MSC移植可以促进神经再生的第二种方式是保护新生长的细胞免受致病环境的影响,以防止细胞死亡。当然,减少神经炎症可以防止细胞死亡。最近的一项研究表明,载有MSC球体的胶原水凝胶不仅可以促进神经发生,还可以通过创造微环境生态位来减少神经炎症,从而抑制神经元炎症反应。促进神经发生是MSC治疗的重要机制,通过修复受损部位使患者从中风中恢复。然而,由于神经干细胞(NSCs)再生能力有限,生理环境复杂,其修复效果并不理想。因此,MSCs可以通过产生不同种类的营养因子和抗凋亡分子来促进NSCs向神经元的分化。因此,未来的研究应侧重于开发与 NSC 相关的 MSC 细胞疗法,以促进神经系统的恢复。
减少梗塞体积
MSCs减少的梗死体积与细胞来源、研究的物种和中风后 MSC 注射的时间有关。体内实验表明,ADSCs、BMSCs 以及 UC-MSCs [44]可以减少大鼠的梗死体积。ADSC治疗的小鼠比BMSC治疗的小鼠有更小的梗塞[9]。
ADSCs和ADSC衍生的Exos可以限制脑梗塞的大小并增强神经功能恢复,而不会发生肿瘤。在ADSC衍生的Exos治疗后,急性脑肿胀减少,由梗塞引起的脑萎缩减少。此外,在使用异种ADSC/ADSC衍生的Exos治疗急性缺血性中风的啮齿动物中未发现免疫反应 [50]。
由于MSCs的治疗效果,MSCs和重组组织纤溶酶原激活剂(rtPA)的联合治疗可以改善 rtPA 治疗的结果。事实上,与单独的两种治疗相比,静脉注射MSCs和rtPA治疗的脑出血大鼠的梗死体积显著减少。如果静脉rtPA治疗后出现出血并发症,注射的MSC可能会抑制内皮功能障碍,从而抑制出血事件 [51]。
更换损坏的细胞
间充质干细胞的移植可能有助于脑组织再生,部分原因在于它们在适当条件下分化成神经元和神经胶质细胞的潜力。MSC 分化成神经元需要两个因素。首先是MSCs表达巢蛋白,巢蛋白是MSCs中相应外在信号的标记。第二种是间充质干细胞和神经元之间的直接细胞-细胞相互作用,允许整合外在信号[52]。
几十年来,研究表明,间充质干细胞可以分化为神经元和神经胶质细胞。在早期的研究中,MSCs 被成功诱导为巢蛋白 (+) 神经球,并在含有表皮生长因子 (EGF) 和碱性成纤维细胞生长因子 (bFGF) 的培养基中培养。在培养基中的有丝分裂原撤出后,这些神经球可以分化成神经丝 (+) 神经元或胶质纤维酸性蛋白 (GFAP) (+) 胶质细胞[53]。
最近的研究描述了一种参考神经基底培养基,其中MSC可以分化为神经元。首先在含有成纤维细胞生长因子 (FGF) 和 bFGF 的培养基中培养MSC。9天后,培养基中添加了BDNF和GDNF。然后将细胞在该培养基中再培养3天 [11]。有鉴于此,未来的研究可能旨在继续改进这种培养基,以获得更好的培养方案来促进MSCs的分化。
通过细胞外囊泡(EVs)发挥治疗作用
基于MSCs的旁分泌机制,具有遗传调控信息的EVs可以由MSCs分泌,成为无细胞治疗的新策略。与神经祖细胞的EVs相比,MSCs的EVs具有更好的治疗效果[54]。MSCs 的EVs包括Exos和微粒 (MPs)。Exos具有毒性低、免疫原性低、可生物降解、能够包封内源性生物活性分子、能够穿越血脑屏障等优点[55]。目前的研究主要集中在从BMSC、ADSC 和UC-MSC [16] 中分离出的Exos和MPs的功能。
由于细胞外囊泡中的活性物质包括一些蛋白质和 microRNAs (miRNAs),MSCs 的外囊泡通过这些 miRNAs 发挥各种调节机制。这样,miRNA 可以被蛋白质激活并与其相应的靶标结合,从而影响下游信号并产生治疗效果 [56]。MSC-EVs 给药后,B 淋巴细胞、T 淋巴细胞和NK细胞减少,为脑重塑提供了合适的抗炎环境[57]。
此外,MSC-EV显著减少了梗死体积和神经元损伤 [58]。它们还可以增加内皮细胞的迁移和管形成,以促进血管生成 [59]。
02 不良反应
许多临床前研究全面调查了MSC治疗的副作用。据报道,间充质干细胞治疗从未在人类中证明促进肿瘤形成风险的增加 [62],但也有一些轻微的不良事件。一项研究表明,一名患者在注射时出现轻度瘙痒,一名患者出现轻度发烧和恶心,一名患者出现轻度食欲不振 [65]。
一般来说,静脉注射体外培养的自体MSCs是一种安全可行的缺血性卒中治疗方法[66],但其治疗效果有待提高。低氧预处理的干细胞表现出更好的细胞存活率、增加的神经元分化、增强的旁分泌效应、增加的营养支持和改善对病变部位的归巢能力 [68]。
03 结论
综上所述,MSCs的多种治疗机制和作用已被揭示,从本质上讲,MSC 疗法已被提议作为一种用于组织修复和再生的生物细胞疗法 [69]。
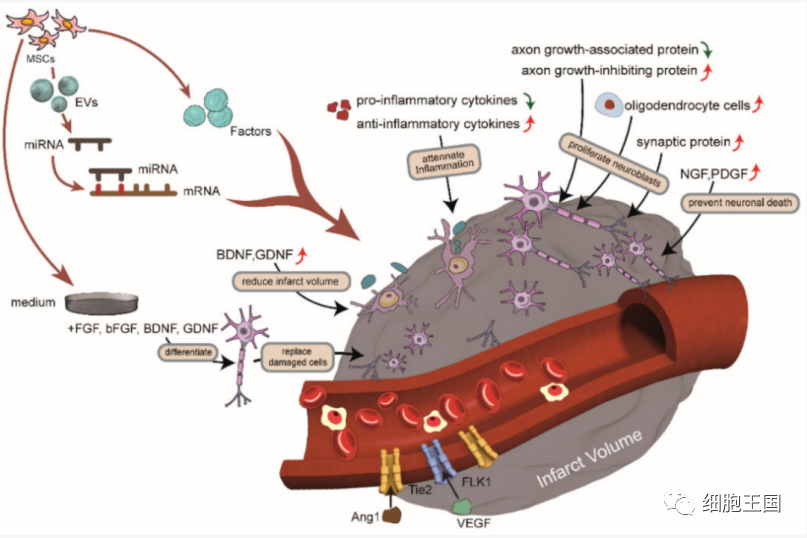
间充质干细胞 (MSCs) 和 MSCs 分泌的细胞外载体 (EVs) 治疗中风的机制
MSCs与药物或基因修饰的联合治疗是该领域研究的重点。例如,将载有hADSC的P5肽给予卒中后大鼠创造了支持载药hADSC存活的条件,载有p5肽的hADSC减少了病灶周围炎症细胞的数量[74]。基因修饰的MSCs 可以表达具有生物活性的基因产物,因此可以作为将治疗性基因转移到大脑的有效载体。因此,基因修饰的MSC疗法是治疗中风的有用方法[23]。
本文很好的总结了间充质干细胞治疗中风的作用机制,提出了许多MSCs治疗脑卒中的新思路,希望对未来的研究有所启发和帮助,使更多中风患者尽快受益。
参考文献
1.Mesenchymal Stem Cells: Therapeutic Mechanisms for Stroke.Int. J. Mol. Sci. 2022, 23(5), 2550; https://doi.org/10.3390/ijms23052550
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论