CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Nat Biotechnol:利用改进的CRISPR-Cas9基因编辑系统将较长的DNA序列高效引入细胞基因组中的精确位点
doi:10.1038/s41587-022-01418-8
CRISPR-Cas9基因编辑系统的一种新变体使得它更容易为治疗应用而对大量细胞进行基因改造。美国格拉斯通研究所和加州大学旧金山分校开发的这种方法让科学家们能够以非常高的效率将特别长的DNA序列引入细胞基因组的精确位置,而不需要传统上用来携带DNA进入细胞的病毒递送系统。相关研究结果于2022年8月25日在线发表在Nature Biotechnology期刊上,论文标题为“High-yield genome engineering in primary cells using a hybrid ssDNA repair template and small-molecule cocktails”。
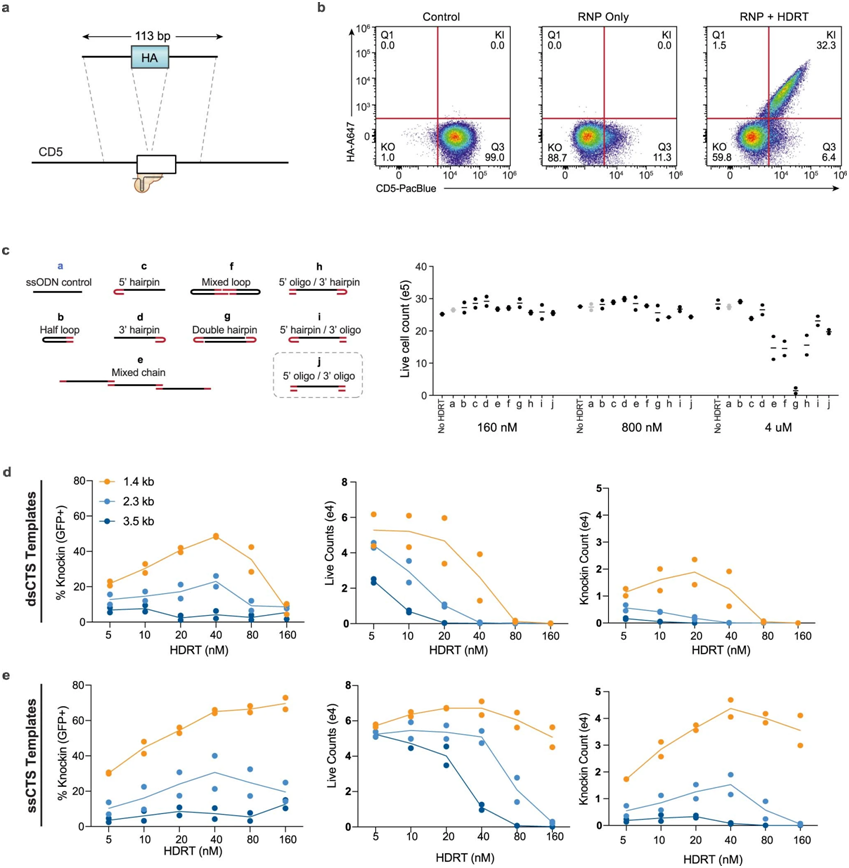
CTS(Cas9 target sequence,Cas9靶序列)模板设计的比较,图片来自Nature Biotechnology, 2022, doi:10.1038/s41587-022-01418-8。
DNA可以以单链或双链形式存在,而Cas9会附着在双链DNA上。这些作者很快发现,高水平的双链DNA模板对细胞有毒,因此该方法只能用于低量的模板DNA,这会导致编辑效率低下。他们知道单链DNA对细胞的毒性较小,即使在相对高的浓度下也是如此。因此,在这篇新的论文中,他们描述了一种将改良的Cas9酶附着在单链DNA模板上的方法,只需在两端添加一小段悬空的双链DNA。与传统的双链DNA模板相比,单链DNA模板可以使基因编辑的效率提高一倍以上。单链DNA分子的双链末端让人们可以使用Cas9来加强非病毒载体在细胞中的递送。
在这项新的研究中,这些作者使用新的DNA模板产生了超过10亿个靶向多发性骨髓瘤的CAR-T细胞。CAR-T细胞是经过基因改造的T细胞,可以有效对抗特定的细胞或癌症。有了新的由Cas9指导的单链模板,大约一半的T细胞获得了新的基因,因而被转化为CAR-T细胞。
论文共同作者、加州大学旧金山分校血液学与肿瘤学科医学助理教授Justin Eyquem博士说,“我们知道,将DNA模板靶向基因组中称为TRAC(T-cell receptor α constant, T细胞受体α恒定区)位点的特定位点,将会提高CAR-T细胞的抗肿瘤效力。这种新的非病毒方法使我们能够更有效地实现这一目标,这将加快下一代CAR-T细胞疗法的开发。”
2.Nature:重大进展!抑制RASA2基因可让T细胞在肿瘤微环境中持续杀死癌细胞,有望治疗一系列实体瘤和液体肿瘤
doi:10.1038/s41586-022-05126-w
用于免疫治疗的T细胞会因为对抗癌细胞的任务而变得功能衰竭,或者在进入肿瘤时失去活性。在一项新的研究中,通过对这些细胞的基因组进行基于CRISPR的编辑,来自美国加州大学旧金山分校、格拉斯通研究所和以色列特拉维夫大学的研究人员使这些治疗性的T细胞变得更有活力。这一发现可能有助于克服限制这种有希望的疗法成功遏制实体瘤和液体肿瘤的一个主要因素。相关研究结果于2022年8月24日发表在Nature期刊上,论文标题为“RASA2 ablation in T cells boosts antigen sensitivity and long-term function”。
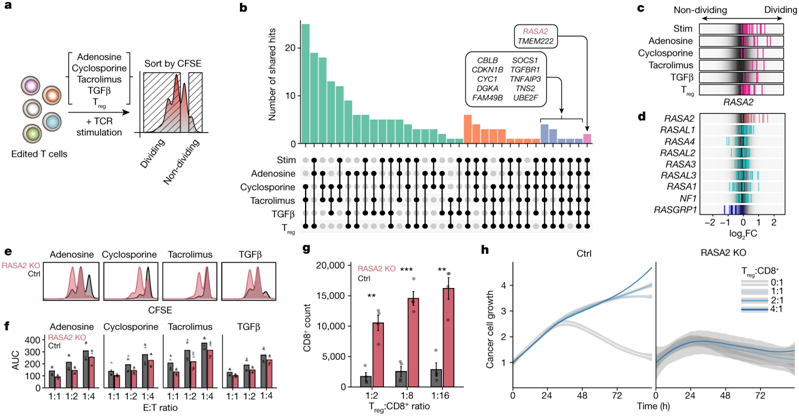
在原代人T细胞中进行的多种全基因组CRISPR筛选发现RASA2是一种抵抗免疫抑制环境的调节因子。图片来自Nature, 2022, doi:10.1038/s41586-022-05126-w。
这些作者构建出敲除RASA2基因的T细胞。他们然后让这些T细胞接受各种 “应激测试”,让它们反复暴露在癌细胞以及肿瘤微环境模型中。他们将这些RASA2基因敲除的T细胞的表现与仍然含有正常RASA2基因的原始治疗性T细胞的表现进行了比较。在原始的T细胞失去抗癌能力很久之后,RASA2基因敲除的T细胞仍然非常不知疲倦。
这些作者在对不同类型的阻断RASA2的工程化T细胞进行了测试以及对来自许多不同人类供者的T细胞以及液体癌症和实体瘤模型进行了测试,他们获得的结果是一致的。Carnevale说,“这些敲除RASA2基因的T细胞可以持续杀死癌细胞。我们似乎找到了T细胞功能的抑制因子,当我们去除它时,我们就能释放出这些治疗性T细胞的潜力。”
3.Science子刊:重大进展!注射一种水凝胶有望治疗胶质母细胞瘤
doi:10.1126/scitranslmed.abn1128
美国威斯康星大学麦迪逊分校药学院药物科学部助理教授Quanyin Hu解释说,“胶质母细胞瘤的一个特点是,肿瘤细胞非常具有侵略性,它们会渗透到周围的组织中。所以外科医生不能清楚地感觉到肿瘤和正常组织之间的界限,而且你不能尽可能多地切除,因为大脑中的所有组织都非常重要---你当然不想切除太多。因此,这种肿瘤会再次复发,而这大大降低了治疗后的存活率。”
但是Hu实验室已开发出一种强大的免疫增强性术后治疗方法,可能改变胶质母细胞瘤患者的胜算。在一项新的研究中,Hu和他的合作者发表了他们关于该疗法在人类胶质母细胞瘤小鼠模型中的应用。相关研究结果发表在2022年8月3日的Science Translational Medicine期刊上,论文标题为“Intracavity generation of glioma stem cell–specific CAR macrophages primes locoregional immunity for postoperative glioblastoma therapy”。

Hu实验室开发了一种水凝胶,它可以被注射到切除肿瘤后留下的脑腔中。Hu指出,这种水凝胶给送方法效果很好,因为它完全填满了脑腔,缓慢地将它携带的纳米颗粒释放到周围组织中,并促进杀癌免疫反应。
这种水凝胶含有携带着编码嵌合抗原受体(CAR)的基因的纳米颗粒,这些纳米颗粒旨在进入某些类型的免疫细胞---称为巨噬细胞---并使它们表达可以靶向胶质瘤干细胞的CAR,由此产生的巨噬细胞称为CAR巨噬细胞(CAR macrophage, CAR-M)。这些免疫细胞通常会清理体内的传染性入侵者,但在肿瘤环境中,它们可能会转变为抑制免疫系统和促进癌症生长的形式。由于手术造成的炎症,这些叛变的巨噬细胞会涌向手术部位,可能会助长癌症复发。Hu说,“我们想利用这些巨噬细胞,把它们从敌人变成盟友。”
为了做到这一点,这些纳米颗粒进入这些巨噬细胞并使它们表达的CAR靶向一种叫做CD133的糖蛋白,这是胶质瘤干细胞的一种标志物。Hu及其研究团队还添加了一种CD47抗体,它能阻止“不要吃我”的信号,从而促进CAR-M细胞识别癌细胞。针对小鼠模型的临床前结果显示这种水凝胶治疗成功地产生了胶质瘤干细胞特异性的CAR-M细胞 ---本质上就是在现场对巨噬细胞进行重编程,使之靶向并杀死任何残留的胶质瘤干细胞。
4.Blood:不表达CD7的CAR-T细胞有望更好地治疗T-ALL白血病
doi:10.1182/blood.2021015020
在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员改进了嵌合抗原受体(CAR)T细胞(CAR-T)疗法。他们新的简化方法选择了一种有利的T细胞类型,并在实验室中显示出对抗复发的T细胞急性淋巴细胞白血病(T-ALL)的前景。相关研究结果于2022年8月1日在线发表在Blood期刊上,论文标题为“Engineering Naturally Occurring CD7 Negative T Cells for the Immunotherapy of Hematological Malignancies”。
几种治疗复发性T-ALL的CAR-T细胞疗法靶向抗原CD7。这种抗原存在于许多T-ALL癌细胞表面上,就像这些癌细胞挥舞着同样的旗帜一样。然而,有一个问题。论文共同第一作者、圣犹大儿童研究医院的Abdullah Freiwan说,“大多数正常T细胞也表达CD7,而且因为这些CAR-T细胞战士完全听从命令。它们会杀死任何携带这种特定标志物的细胞,即使这意味着互相残杀。”
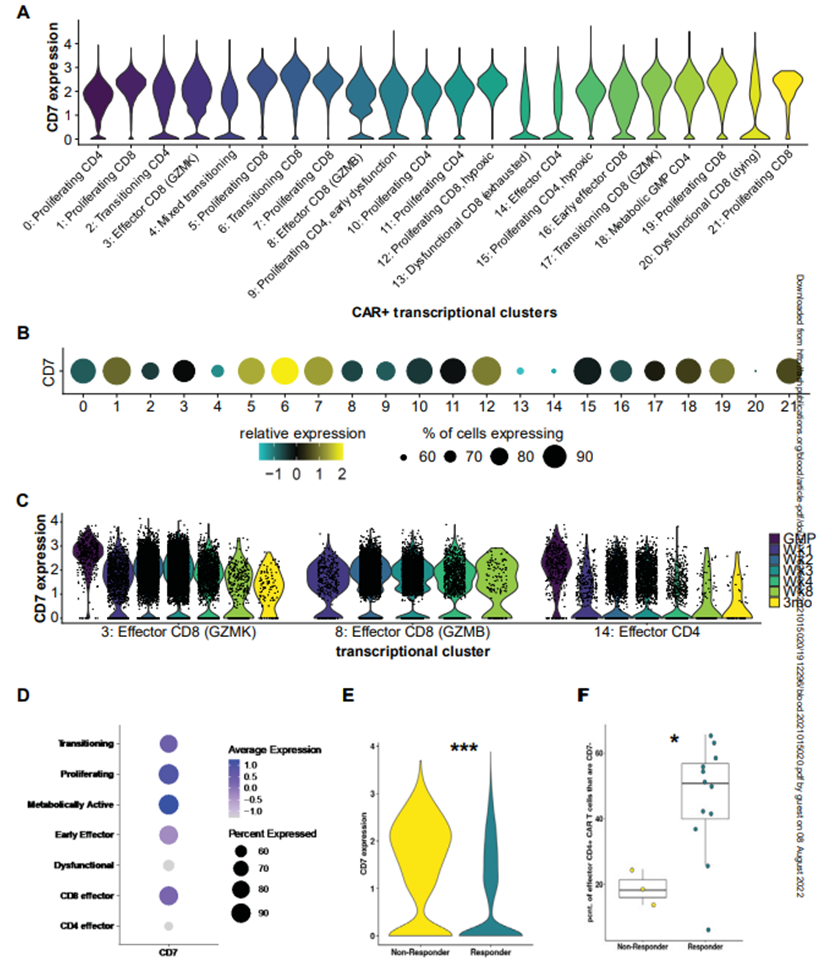
图片来自Blood, 2022, doi:10.1182/blood.2021015020。
这些作者专注于一小群天然不表达CD7的T细胞。他们产生了一种选择和扩大这些细胞的方法,然后将它们制成CAR-T细胞。在实验室研究中,这些不表达CD7的CAR-T细胞表现非常好,有效地清除了肿瘤。在小鼠模型的癌症复发实验(再挑战)中,这些细胞还提供了长期保护。
5.Science子刊:新方法让功能衰竭的T细胞恢复青春,有望改善癌症免疫疗法
doi:10.1126/sciimmunol.abj9123
在与癌症斗争的过程中,T细胞会变得功能衰竭,不再能够正常运作。在功能衰竭的早期阶段有时可以用免疫治疗药物加以逆转,但一旦T细胞变得过于衰竭,人们之前认为这种状态是不可逆转的。然而,在一项新的研究中,来自美国匹兹堡大学的研究人员指出即使是最为衰竭的T细胞也能恢复活力。相关研究结果发表在2022年8月5日的Science Immunology期刊上,论文标题为“Tumor microenvironmental signals reshape chromatin landscapes to limit the functional potential of exhausted T cells”。
在这项新的研究中,这些作者剖析了T细胞在黑色素瘤小鼠模型中从早期到晚期衰竭的分子特征。他们出乎意料地发现,即使是最末期衰竭的T细胞也保留了一些再次发挥作用的能力,并确定了克服衰竭的方法,从而为癌症免疫疗法开辟了潜在的新途径。
为了完全激活,T细胞有两个开关:T细胞受体和一种共刺激信号。这些作者发现,末期衰竭的T细胞没有足够的共刺激信号。当他们使用一种结合称为4-1BB的共刺激受体的抗体时,基因表达增加,从而增强了T细胞的活性。另一个关键发现是,在肿瘤微环境中常见的低氧或缺氧促成了末期衰竭T细胞的基因表达受损。当这些作者对T细胞进行重编程,使它们对缺氧有抵抗力时,它们就会分化成一种更有功能的状态。
这些作者说,利用末期衰竭的T细胞进行免疫治疗的潜在新方法包括靶向缺氧或共刺激途径的药物或设计对抗功能衰竭的CAR-T细胞。
6.Cell子刊:新方法大批量生产具有强大抗肿瘤活性的中性粒细胞
doi:10.1016/j.celrep.2022.111128
在一项新的研究中,来自美国普渡大学的研究人员对传统方法进行了改进,生产出现成的具有强大抗肿瘤活性的人类免疫细胞。相关研究结果发表在2022年7月19日的Cell Reports期刊上,论文标题为“Engineering chimeric antigen receptor neutrophils from human pluripotent stem cells for targeted cancer immunotherapy”。
论文共同通讯作者、普渡大学戴维森化学工程学院助理教授Xiaoping Bao说,经过基因改造后表达嵌合抗原受体(CAR)的中性粒细胞(以下称CAR中性粒细胞)以及可移植的造血干细胞是治疗血液疾病和癌症的有效方法。中性粒细胞是最丰富的白细胞类型,能有效地穿过生理屏障渗透到实体瘤中。造血干细胞将在一生中补充所有的血细胞谱系,包括中性粒细胞。
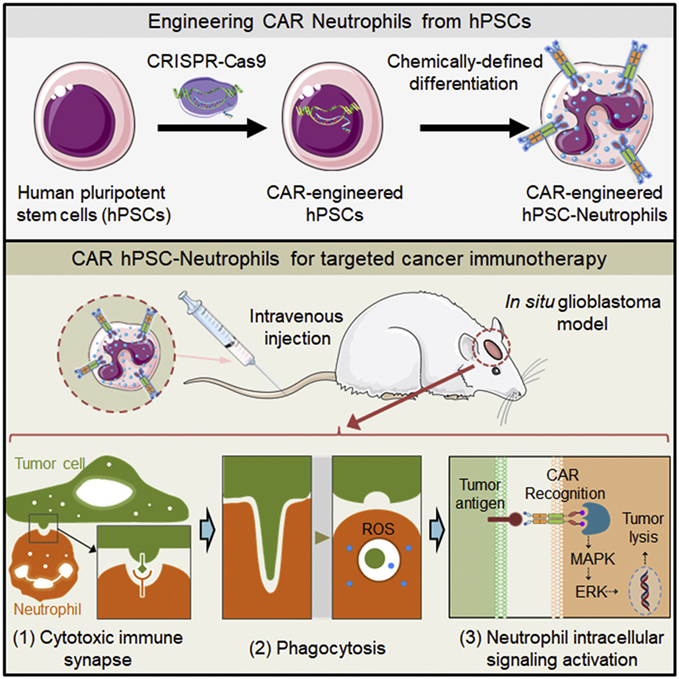
图片来自Cell Reports, 2022, doi:10.1016/j.celrep.2022.111128。
Bao开发了一种提交了专利申请的方法:利用人类多能性干细胞(hPSC)---即可以自我更新并能分化为任何类型人细胞的干细胞---大量产生CAR中性粒细胞。经过基因改造后,CAR可在hPSC表面上表达,然后通过一种新的、化学定义的方法将它们转化为功能性的CAR中性粒细胞。
7.Haematologica:表达MyD88和CD40的ENG T细胞有望更高效地治疗急性骨髓性白血病
doi:10.3324/haematol.2021.279301
在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员开发出一种来提高CD123特异性的engager(ENG)T细胞杀死急性骨髓性白血病(AML)的能力。该方法在针对难以治疗的复发疾病的临床前模型中显示出前景。相关研究结果于2022年7月28日在线发表在Haematologica期刊上,论文标题为“Improving the anti-acute myeloid leukemia activity of CD123-specific Engager T cells by MyD88 and CD40 costimulation”。
尽管小儿白血病治疗取得了进展,但复发性AML的临床结果仍然不佳。科学家们正在探索多种潜在的治疗方法。一种方法是使用ENG T细胞。这些细胞是经过基因改造的免疫细胞,可以分泌使T细胞和癌细胞结合在一起的抗体,促进对肿瘤的杀伤。在这种新的研究中,这些作者开发出一种改进ENG T细胞的方法,使该疗法更加高效和有效。他们在ENG构造体中加入了一个由一种称为二聚化学诱导剂(chemical inducer of dimerization)的小分子激活药物控制的共刺激系统,该系统由共刺激分子MyD88和/或CD40组成。临床前研究结果显示,该方法提高了ENG T细胞的抗AML活性。
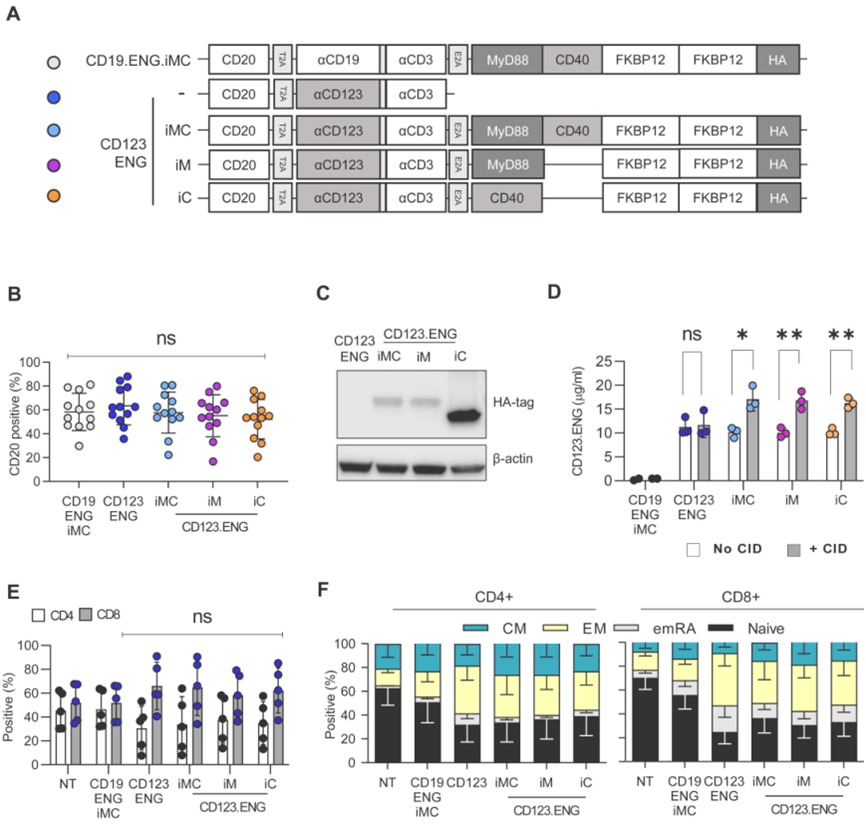
图片来自Haematologica, 2022, doi:10.3324/haematol.2021.279301。
论文通讯作者、圣犹大儿童研究医院骨髓移植与细胞治疗系Paulina Velasquez博士说,“我们基本上是让T细胞表达我们可以控制的共刺激分子。ENG T细胞分泌一种蛋白,使这些T细胞能够杀死白血病。在这种情况下,当它们也表达我们添加的共刺激分子时,我们让这些细胞获得额外的效应功能。”
8.Cell Stem Cell:重磅!科学家有望制造出更好的现成可用的CAR-T细胞来用于癌症免疫疗法
doi:10.1016/j.stem.2022.06.014
在CAR-T细胞免疫疗法中,来自患者自身血液中的T细胞能被工程化改造为携带嵌合抗原受体(CAR),从而增强T细胞攻击和杀灭肿瘤细胞的能力,当CAR-T细胞疗法能作为治疗特定白血病和淋巴瘤的强大手段时,很多病人仍然无法使用这种有效的疗法。近日,一篇发表在国际杂志Cell Stem Cell上题为“EZH1 repression generates mature iPSC-derived CAR T cells with enhanced antitumor activity”的研究报告中,来自波士顿儿童医院等机构的科学家们通过研究或有望让CAR-T细胞疗法能够更加广泛地使用。
本文研究中,研究人员就利用诱导多能干细胞(iPSC)开发了一种新方法来制造通用型的CAR-T细胞,其或能大规模生产并用于多名患者的治疗。在研究涉及血液发育的表观遗传学因素时,研究人员锁定了一种名为EZH1的酶类,其能限制成熟淋巴细胞的分化,而抑制EZH1则能促使iPS细胞制造成熟的T细胞,同时研究人员还开发了一种新型培养系统,其能避免与鼠源性细胞共培养,因为后者的培养较为困难,而且产生的T细胞也并不够成熟。
当iPS细胞衍生的T细胞被进一步转化为CAR-T细胞时,其所显示出的抗肿瘤活性就与目前用于临床疗法的方法所产生的CAR-T细胞的抗肿瘤活性相当,当与此前iPS细胞方法所制造的T细胞相比,这些新细胞在实验室中杀灭癌细胞和清除活体小鼠癌细胞的能力都有所增强。研究者Daley表示,经过多年的研究,如今我们发现iPS细胞最终或能帮助开发用于治疗诸如癌症等多种人类疾病的新型疗法。
9.JITC:靶向αvβ3的CAR-T细胞有望治疗致命性脑瘤
doi:10.1136/jitc-2021-003816
一项新的研究可能在治疗两种致命性脑瘤--胶质母细胞瘤(glioblastoma, GBM)和弥漫型内因性桥脑胶质瘤(diffuse intrinsic pontine glioma, DIPG)--方面引发变革,同时也可能更好地治疗其他实体瘤。相关研究结果近期发表在Journal for ImmunoTherapy of Cancer期刊上,论文标题为“Targeting of the alphav beta3 integrin complex by CAR-T cells leads to rapid regression of diffuse intrinsic pontine glioma and glioblastoma”。
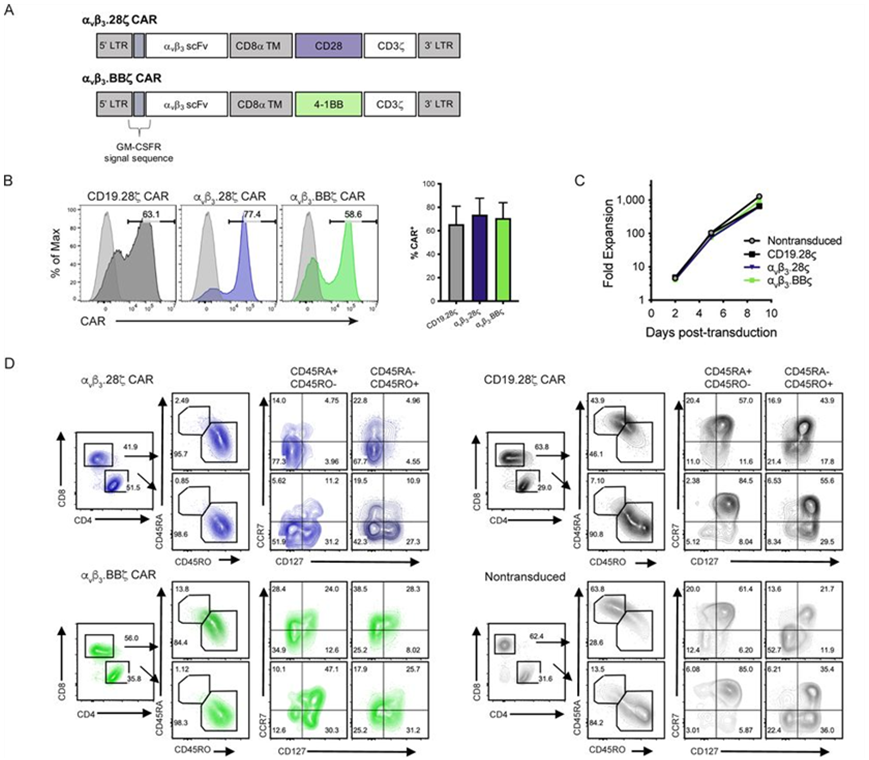
逆转录病毒转导和体外扩增后αvβ3 CAR-T细胞的设计、生产和免疫表型表征。图片来自Journal for ImmunoTherapy of Cancer, 2022, doi:10.1136/jitc-2021-003816。
这项新的研究重点关注两种缺乏有效治疗手段的脑瘤---GBM和DIPG。平均来说,只有不到7%的胶质母细胞瘤患者能存活5年,而对于儿童来说,DIPG的预期寿命在诊断后仅为9个月。
这项新研究发现了这些实体脑瘤的弱点,这些弱点可能使CAR-T细胞免疫疗法对它们也有效。这些作者通过流式细胞仪发现患者来源的DIPG细胞和GBM细胞系在细胞表面上表达高水平的αvβ3,而通过RNA测序和蛋白芯片发现,αvβ3在正常组织上的表达量很小。基于这一发现,他们构建出靶向αvβ3的CAR-T细胞(下称αvβ3 CAR-T)。αvβ3 CAR-T细胞在细胞毒性试验以及在原位和立体定向植入DIPG和GBM肿瘤到NSG小鼠大脑的相关位置的体内模型中都表现出高效的抗原特异性肿瘤细胞杀伤力。由于CAR-T的全身性细胞增殖和长效持久性,它们的抗肿瘤反应是快速和强大的。肿瘤清除后,可检测到TCF-1+ αvβ3 CAR-T细胞,这强调了它们持续存在并进行自我更新的能力。
10.Mol Ther:抑制EBAG9可增强CAR-T细胞的抗肿瘤功能,同时降低副作用
doi:10.1016/j.ymthe.2022.07.009
一个月前,来自德国亥姆霍兹联合会马克斯-德布吕克分子医学中心(MDC)的Armin Rehm博士和Uta Höpken博士及其团队在一项发表在JCI Insight杂期刊上的研究中发现关闭小鼠体内的EBAG9基因导致对癌症的免疫反应持续增加(JCI Insight, 2022, doi:10.1172/jci.insight.155534)。这些小鼠还产生更多的记忆T细胞。记忆T细胞是我们免疫记忆的一部分,使我们的免疫系统在再次遇到之前遇到的癌症抗原后能够作出更好的免疫反应。
如今,在一项新的研究中,这些作者还在体外的人类CAR-T细胞中证实了这些关键发现。他们指出,这是迈向治疗应用的道路上决定性的一步。相关研究结果于2022年7月12日在线发表在Molecular Therapy期刊上,论文标题为“EBAG9-silencing exerts an immune checkpoint function without aggravating adverse effects”。Rehm说,“关闭EBAG9使身体能够更早、更彻底地消灭肿瘤细胞。除了实现更持久的治疗效果外,这也可能创造出真正的治愈机会。”
基于他们在动物模型和使用人类细胞的体外实验中的发现,这些作者如今知道,解除EBAG9对免疫细胞的抑制是非常有效的,并且不会比传统的CAR-T细胞疗法引起更多的副作用。Rehm说,“我们如今需要大胆的临床医生和资助临床研究的合作伙伴。如果一切顺利的话,使用EBAG9沉默的CAR-T细胞的疗法可能在短短两年内就能为患者所用。”
11.eLife:对嵌合抗原受体的跨膜结构域进行改造,可降低CAR-T细胞的毒副作用
doi:10.7554/eLife.75660
作为一种新的免疫疗法,CAR-T细胞疗法能增强患者的杀伤性T细胞来攻击和消除癌症。它对某些血癌的疗效可高达90%,甚至能使一些患者得到长期缓解和治愈。但一个重要的限制是该疗法的有害副作用,大约50%的患者会出现危险的并发症。
在一项新的研究中,来自以色列魏茨曼科学研究所、澳大利亚沃尔特-伊莉莎-霍尔医学研究所、墨尔本大学和拉筹伯大学的研究人员开发出一种潜在地减少CAR-T细胞疗法的毒副作用的方法,这一发现可能会克服这种开创性疗法的最大局限。为此,他们利用这种一种方法确定了一个“黄金”窗口,在安全和疗效之间取得平衡。他们的方法对这种免疫疗法中使用的CAR-T细胞进行了微调,使其活性足以消除癌症,但又不至于强到产生毒副作用。相关研究结果近期发表在eLife期刊上,论文标题为“De novo-designed transmembrane domains tune engineered receptor functions”。论文通讯作者为沃尔特-伊莉莎-霍尔医学研究所的Matthew Call副教授、Melissa Call副教授和魏茨曼科学研究所的Sarel J Fleishman。
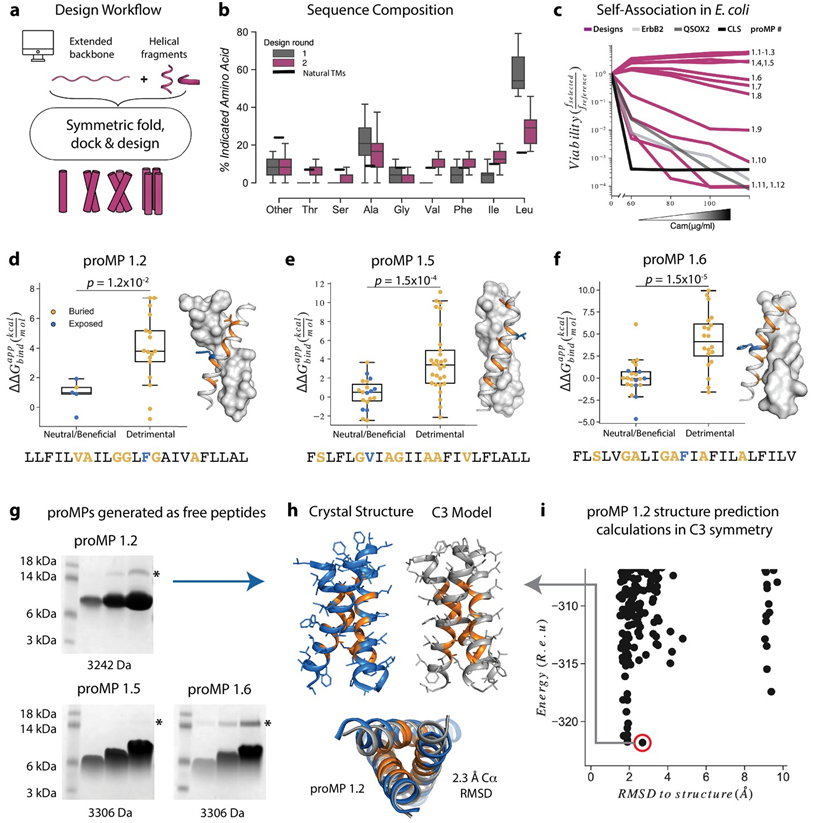
了解可以自组装的膜蛋白的编程规则。图片来自eLife, 2022, doi:10.7554/eLife.75660。
目前还没有办法可靠地预测CAR-T细胞疗法对患者的作用有多强。以前的研究试图通过靶向这种人工传感蛋白的末端部分来微调T细胞,这些末端部分要么与癌细胞结合,要么指示T细胞进行杀伤。与此不同的是,在这项新的研究中,这些作者首次研究完全重新设计这种人工传感蛋白(即CAR)的中间部分:跨膜结构域(transmembrane domain, TMD)。具体而言,他们开发出一种产生程序化膜蛋白(programmed membrane protein, proMP)---通过计算定义的和晶体学验证的界面进行自我组装的单通道α螺旋TMD---的从头设计策略。他们用这些proMP将特定的低聚体相互作用编程到CAR中,并在小鼠初级T细胞中进行表达,发现CAR-T细胞的体外细胞因子释放和体内抗肿瘤活性都与CAR TMD编码的低聚体状态(从单体到四聚体)呈线性关系。相对于常用的CD28 TMD,所有利用程序化的CAR刺激T细胞细胞因子释放大大降低。
这些作者利用魏茨曼科学研究所的计算专长,将天然免疫传感蛋白的片段与定制设计的合成元件拼接在一起,以产生新的回路,可用于调整和评估效力的变化。Matthew说,“专注于这种人工传感蛋白的中间连接片段使我们能够生成不同版本的CAR,我们知道这些CAR更强或更弱,这使我们能够根据患者的效力要求定制它们。能够可预测地调整这种T细胞的活性,大大拓宽了我们的研究范围,与以前的研究不同的是,因为我们靶向存在于每一种免疫疗法情况下的某些靶标。我们首次可以建立适用于任何使用CAR-T细胞免疫疗法治疗癌症的规则。”
12.Cancer Discov:构建单细胞框架,有可能改善CAR-T细胞疗法
doi:10.1158/2159-8290.CD-21-1508
在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员证实在某些情况下,可以在治疗前预测杀死癌症的嵌合抗原受体(CAR)T细胞(CAR-T)的长期表现。该研究提供了一个独特的基于细胞测序的框架来衡量和改善CAR-T细胞免疫疗法的性能。相关研究结果于2022年7月6日在线发表在Cancer Discovery期刊上,论文标题为“Common trajectories of highly effective CD19-specific CAR T cells identified by endogenous T cell receptor lineages”。
这些作者利用实验室中的先进技术,在准备用于治疗的全部CAR-T细胞中,发现了一小部分CAR-T细胞在输注给急性淋巴细胞白血病(ALL)患儿时产生了大部分持久的抗癌活性。他们创建的这种方法框架可作为改进其他CAR-T细胞疗法的模板,为驾驭这些免疫疗法的复杂性提供指导。
论文通讯作者、圣犹大儿童研究医院免疫学系的Paul Thomas博士说,“这是一个令人惊讶的发现。似乎是输注前CAR-T细胞产品中的少数细胞实际上对患者的抗肿瘤反应有贡献。”
13.Nat Biotechnol:开发出一种新的三维成像技术可以实时观察T细胞免疫疗法的作用机制
doi:10.1038/s41587-022-01397-w
在一项新的研究中,来自荷兰乌特勒支大学、马克西玛公主儿童肿瘤学中心和Oncode研究所的研究人员开发出一种新的三维成像技术,它可以让人们实时观察T细胞免疫疗法的工作模式。T细胞免疫疗法已经在一些白血病儿童身上取得了可喜的成果。科学家们计划利用这种新的成像技术来改善针对实体瘤的T细胞疗法。相关研究结果于2022年7月25日在线发表在期刊上,论文标题为“Uncovering the mode of action of engineered T cells in patient cancer organoids”。
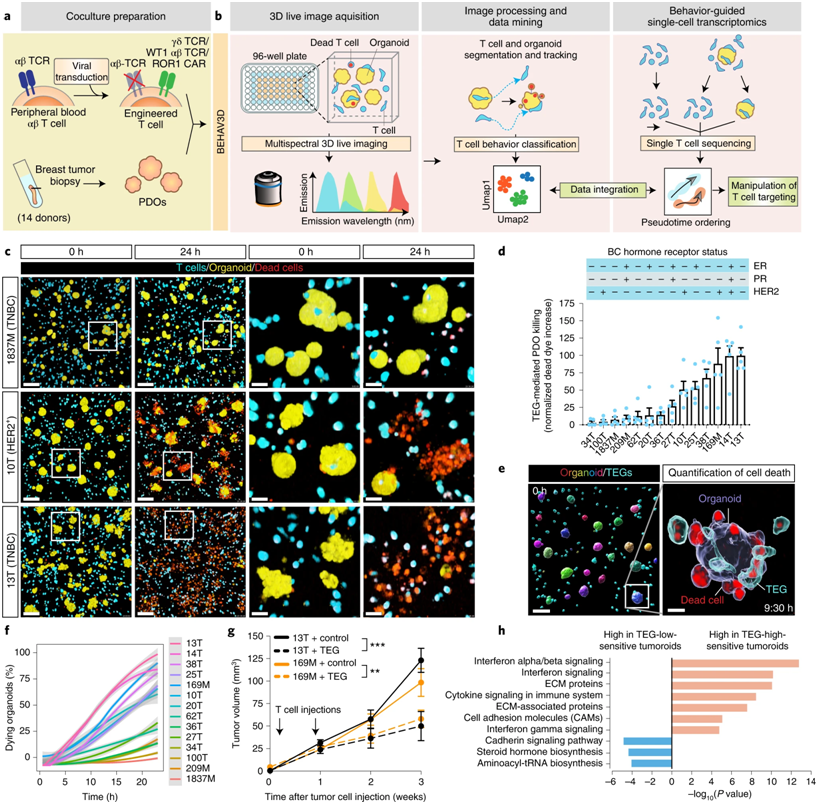
通过多光谱三维实时成像和体内TEG细胞靶向检测TEG细胞对多种乳腺癌亚型类器官的疗效。图片来自Nature Biotechnology, 2022, doi:10.1038/s41587-022-01397-w。
T细胞疗法,如CAR-T细胞疗法,是一种有前途的免疫疗法,在治疗白血病儿童方面已经显示出效果。这类疗法利用人体自身的免疫系统:T细胞。作为一种白细胞,T细胞在实验室中接受基因改造后以有针对性的方式攻击肿瘤。人们也在寻求有效的T细胞疗法来治疗实体瘤,如神经母细胞瘤、肉瘤和肾脏肿瘤。然而,为了提高其临床疗效,我们需要更好地了解T细胞的实体瘤靶向行为。这就是为什么在马克西玛公主儿童肿瘤学中心专门从事三维成像的Anne Rios博士实验室与乌特勒支大学的T细胞治疗专家和小组负责人Zsolt Sebestyén博士和Jürgen Kuball教授博士,以及马克西玛公主儿童肿瘤学中心类器官专家访问研究员Hans Clevers教授博士小组合作。
在这项新的研究中,Rios实验室的Florijn Dekkers博士和Maria Alieva博士开发出一种成像和分析技术:BEHAV3D,可以实时地和三维地分析T细胞疗法和迷你实体瘤(也被称为肿瘤类器官)之间的相互作用。Dekkers说,“这种方法的独特之处在于,我们是通过研究T细胞的行为来观察细胞疗法的疗效。我们总共研究了超过15万个接受过基因改造的T细胞的行为。这揭示了行为的巨大变化,比非常有效的行为,如连续杀死多个肿瘤细胞,但也有无效的行为,细胞只是无所事事。这向我们表明,通过促进最有效的肿瘤靶向行为,有提高临床疗效的空间。”
14.Science:揭示γδT细胞在结直肠瘤中起着两面人的作用
doi:10.1126/science.abj8695
结直肠瘤中充斥着白细胞,但这些细胞是帮助还是阻碍了这种癌症的发生,这一点在科学界引起了激烈的争论。一些研究已表明,白细胞英勇地限制了肿瘤的生长并对抗结直肠癌,但同样令人信服的证据表明,白细胞是恶性的同谋者---助长结直肠瘤并协助它扩散。
如今,一项新的研究阐明了这些肠道白细胞,即gamma delta T细胞(γδT细胞),在结直肠癌中的作用。它证实γδT细胞是一把双刃剑:它们在早期肿瘤中起着抑制作用,但随着肿瘤进展,它们会发生生化变化并改变立场,促进肿瘤生长。这一发现进一步阐明了γδT细胞在肿瘤生长中的作用,并可能为结直肠癌的治疗开辟新的途径。相关研究结果发表在2022年7月15日的Science期刊上,论文标题为“TCR-Vγδ usage distinguishes protumor from antitumor intestinal γδ T cell subsets”。
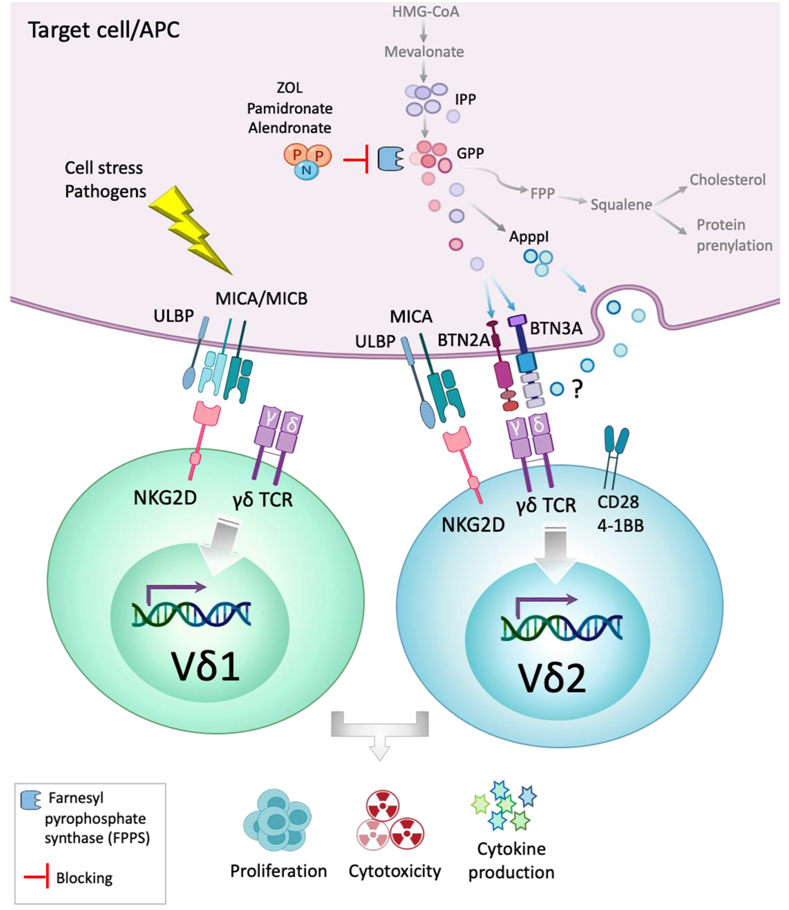
γδ T细胞激活机制。图片来自Cells, 2020, doi:10.3390/cells9051305。
论文共同通讯作者、洛克菲勒大学Daniel Mucida实验室的研究助理Bernardo Reis说,“生活在肠道中的γδT细胞起到了防止肿瘤形成的作用。但是一旦肿瘤形成,肠道γδT细胞群体就会发生变化,进入肿瘤,并促进肿瘤生长。”
在结直肠癌小鼠模型中,Reis及其同事们从患有早期肿瘤的小鼠的肠道和患有晚期癌症的小鼠的肿瘤中提取γδ T细胞。在比较这两种来源的所谓相同的细胞时,他们惊讶地发现它们之间存在巨大的分子差异。例如,这两类γδ T细胞拥有不同的T细胞受体。此外,进入肿瘤的γδ T细胞产生了IL-17,即一种通常在应对感染时促进炎症的细胞因子。然而,在肿瘤微环境中,IL-17起着促进疾病的作用:刺激肿瘤生长,并招募其他细胞来帮助隐藏肿瘤,使其不受免疫系统的影响。Reis说,“这些γδ T细胞已完全改变了。”此外,他们还发现这两类γδ T细胞在T细胞受体Vγδ编码基因的使用方面存在差异:进入肿瘤的γδ T细胞(具有促进肿瘤生长的作用)使用Vγ4/Vγ6,而肿瘤周围的肠道驻留γδ T细胞(具有抗肿瘤作用)使用Vγ1/Vγ7。
为了证实他们的发现,这些作者随后使用CRISPR基因编辑技术有选择地从γδ T细胞中去除T细胞受体,使它们的作用从抗肿瘤变为促进肿瘤,或者利用这种基因编辑技术有选择地从γδ T细胞中添加T细胞受体,使它们的作用从促进肿瘤变为抗肿瘤。通过这种方式,他们成功地增加了小鼠模型中肿瘤的数量,或者缩小了肿瘤的大小。Reis说,“当我们剔除原始γδ T细胞时,小鼠病得更加严重。而当我们剔除侵入肿瘤的γδ T细胞时,肿瘤缩小了。”
15.JITC:科学家或有望利用数学模型来解释癌症患者对免疫疗法的反应
doi:10.1136/jitc-2022-005107
能激活免疫系统寻找并杀灭癌细胞的免疫疗法能大大改善很多实体瘤患者的治疗效果,然而,仍然有一部分患者无法从这类疗法中获益,目前并没有免疫生物标志物能解释有类似疾病和疾病特征的患者为何会出现不同的治疗结果,近日,一篇发表在国际杂志Journal for ImmunoTherapy of Cancer上题为“Rethinking the immunotherapy numbers game”的研究报告中,来自Moffitt癌症研究中心等机构的科学家们通过研究揭示了如何利用数学模型来分析不同癌症疗法对肿瘤和免疫细胞动态学变化的影响,同时还能帮助预测个体化癌症疗法的治疗结果。
众所周知,癌细胞群和周围免疫环境之间的相互作用或会影响癌症的发生和进展,以及患者对免疫疗法的反应,有些患者对免疫疗法的反应很好,而其它患者则不然,目前研究人员并不清楚这些患者之间的差异。研究者Rebecca Bekker说道,就好像早期癌症和晚期疾病的治疗方式不同一样,免疫参与程度不同的肿瘤或许需要非常不同的治疗手段。
为此,研究人员就想通过研究来改善对肿瘤和免疫细胞相互作用的理解,从而帮助预测患者的治疗结局并识别出最佳的治疗手段,知晓这些动态学变化非常复杂,且难以在实验室环境下进行研究,研究人员采用了另外一种方法,借助数学建模来对这些相互作用进行概念化分析,他们开发了一种新型模型来模拟随着时间延续肿瘤细胞和免疫细胞组合之间所有可能的相互作用,其中包括肿瘤生长和消除的速率,以及免疫细胞招募和耗竭的相关参数等,这种模型最后的结果要么是出现免疫逃逸(即肿瘤细胞增长到其最大潜力),要么就是通过免疫细胞的抗肿瘤活性来控制肿瘤。
随后研究人员利用这种模型来模拟并预测不同类型疗法的治疗结局,包括影响肿瘤细胞或免疫细胞群尺寸的细胞毒性化疗和基于细胞的免疫疗法,以及影响肿瘤和免疫细胞群体之间相互作用性质的免疫检查点抑制剂,同时研究人员还解决了组合性疗法的治疗潜在结局。这种模型或能帮助分析如何让不同疗法进行组合,从而通过对肿瘤细胞群进行免疫细胞控制来为患者实现最佳的治疗效果,未来,研究人员希望这种新型数学模型能在临床中使用来帮助预测患者对疗法的反应并指导疗法的进行。研究者Heiko Enderling说道,数学抽象肿瘤学研究或能提供一种新型有潜力的方法来分析不同癌症疗法对患者肿瘤和局部免疫环境的影响效应,并能提供一种新机会来重新思考免疫治疗的游戏规则。
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论