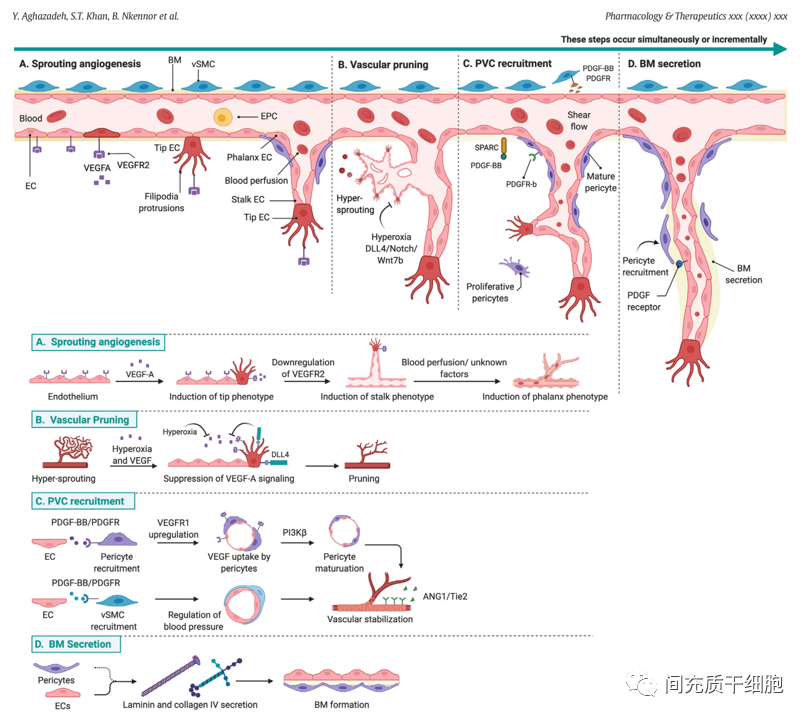
血管系统是维持移植物功能和移植物细胞长期存活所必需的。生理条件下,血管生成和血管退化都是受到一定限制。血管生成被定义为从现有血管中形成新的毛细血管,包括几个步骤,包括刺激内皮细胞、细胞外基质降解、内皮细胞迁移和增殖、毛细血管形成,以及最终通过周内皮细胞稳定新形成的管。
1,微血管系统
除了屏障和代谢物质交换外,微血管还通过表达血管分泌因子而具有分泌和免疫功能。在许多情况下,微血管修复或再生以恢复微循环健康是治疗该疾病的必要组成部分。微血管功能不全,即由于低血管密度和/或血管动力学受损而导致组织灌注减少的情况,会导致组织缺血、溃疡不愈合、组织代谢受限等许多慢性和危及生命的疾病,甚至与衰老有关的并发症。最典型的离子就是糖尿病伴有血管并发症可进一步延迟糖尿病患者的血运重建。
可以从啮齿动物或人类脂肪或脑组织中分离出完整的微血管片段,分离后的微血管保留内皮化管腔、血管周细胞(perivascular cells,PVC)覆盖和3D空间结构。微血管分泌一系列血管生成因子,如HGF、VEGF和PDGF-BB,它们介导血管生成扩张和与血管周细胞的相互作用。当移植到体内时,微血管会形成由小动脉、毛细血管和小静脉组成的分级血管网络,经历了形成稳定血管网络所必需的3个阶段:新生血管生成、新生血管重塑和网络结构成熟。
非常需要注意的是,对65例冠状动脉粥样硬化患者进行分析,与微血管功能正常的健康人冠状动脉相比,患者的微血管功能异常的冠状动脉段显示出较低的内皮剪切应力(endothelial shear stress,ESS),提示患者在早期就出现了冠脉微血管功能异常可能先于冠状动脉疾病。2021年《JAMA Cardiology》36名无阻塞性心外膜CAD患者中有29名有CMD证据。有持续性缺血症状和临床体征,但是又没有阻塞性冠状动脉疾病(INOCA)的血管造影证据的女性中,约8%在血管造影评估后的10年内死于心脏病,而且与无症状女性相比,其发生率高出10倍(3.3%对0.3%)。但是,目前的治疗常常只是改善心绞痛等症状和提高生活质量,并不能有效恢复正常的微血管功能。因为,由于血管较小,冠状动脉循环中的微血管功能障碍经常被血管造影所忽略,但可以通过多普勒超声获得的冠状动脉血流储备(CFR)来确定。CFR≤ 2.5被认为是冠状动脉微血管功能障碍(CMD)。皮肤微血管功能可以通过各种非侵袭性到轻度侵袭性的临床评估来衡量。
微血管再生或修复是一个多阶段的渐进性变化过程。有效灌注的修复不仅涉及产生新的微血管和血管网络,从而可以满足组织的灌注、代谢和功能需求。治疗性血管生成的研究,目前是使用细胞生长因子结合并激活内皮细胞表面的受体,使内皮细胞进入增殖状态。微血管的药理学治疗依然不能解决病理性微血管本身或其再生问题。对于治疗性血管生成和动脉疾病等疾病,微血管再生仍局限于实验领域。例如,用于心肌梗死后微血管再生的重组血管内皮生长因子(VEGF)和其他生长因子疗法已经完成了临床试验,其中VEGF在缺血状态下用于血管新生、Euroinject One试验和Kuopio血管新生试验报告了与安慰剂相比无明显差异。由于单一成份的药物或物质,已经无法满足微血管再生和修复,许多基于干细胞的疗法在再生或改善微血管形态和功能方面显示出更大的前景。这些细胞疗法主要通过分泌多种因子或外泌体在旁分泌因子中发挥作用。
2,基底膜
基底膜是血管系统的脱细胞成分,富含多种功能蛋白,由内皮细胞和血管周细胞分泌,对血管的完整性和稳定性至关重要。基底膜支持内皮细胞和血管周细胞之间的相互作用,并为血管和周围非血管组织提供机械信号。基底膜已被鉴定出40多种基底膜蛋白质,它们的组合/比率在不同组织之间存在显著差异。
然而,血管基底膜的主要成分是层粘连蛋白和IV型胶原,它们由nidogen蛋白和硫酸乙酰肝素蛋白聚糖连接,形成3D片状结构。这些蛋白质在基底膜中分布不均匀,空间或成分变化可改变基底膜硬度,并调节细胞穿过血管壁的迁移,从而导致细胞入侵(癌症发病机制、免疫细胞招募等),改变血管生成或细胞增殖率。
3,血管系统的关键细胞类型
(1)内皮细胞
血管周围细胞的功能正常有助于血管完整性和屏障功能。内皮细胞是血管周围细胞群体中最重要的一种细胞类型。内皮细胞的α-平滑肌肌动蛋白(α-SMA)参与了血管收缩和血流调节。在静止状态下,内皮细胞也需要线粒体产生ATP的能量来维持生理功能和稳态。内皮细胞中大多数ATP是通过糖酵解代谢产生的,虽然内皮细胞的位置靠近血流并与足够的氧气接触。在内皮细胞糖酵解产生ATP的生理过程中,内皮细胞的生长和增殖伴随着糖酵解代谢的增加,糖酵解代谢的增加又依赖于PFKFB3活性的上调,所以PFKFB3酶活性对调节内皮细胞的糖酵解至关重要。
原代内皮细胞具有较高的免疫原性,异体移植治疗能引起免疫排斥,因而需要搭配免疫抑制药品的使用。不过,大血管内皮细胞不表达MHC-II类分子,因此其免疫原性低于微血管内皮细胞。再生研究中使用的血管细胞最常见的来源是来自人体组织的原代内皮细胞。原代人内皮细胞可从活组织或其他可获得的组织中获得,如脐带静脉和脂肪组织,并在体外扩增几代。人脐静脉内皮细胞(HUVEC)于1974年首次分离和培养,是临床前研究中最常用的内皮细胞来源。因为内皮细胞根据血管结构树的空间定位显示出独特的生理和转录组学特征,因而人脐静脉内皮细胞是从大血管静脉获得的,它们可能不适合生成微血管或动脉,因此,人脐静脉内皮细胞和其他原代内皮细胞在临床上的应用面临着一些困难。
自体内皮细胞的临床应用也受到一些限制,比如自体内皮细胞分离率低及其增殖能力较弱,因此可以采用iPS技术来获得自体内皮细胞。但是iPS分化为内皮细胞的分化效率低下(约30%),而且含有多种异质性细胞群和未分化的细胞,临床应用的安全性隐患非常大。使用改造的mRNA或慢病毒转导技术,可以提高iPS分化为内皮细胞的效率到90%,但是依然有残留的其他细胞群体。
从皮肤或小组织活检中分离出来的人类微血管内皮细胞,在体外形成毛细血管样网络[37]。然而,也观察到体内移植的脑微血管内皮细胞不会形成功能性血管系统,而是促进宿主血管系统的血管生成,并随后被替代而消失。
(2)周细胞(间充质干细胞)
周细胞嵌入血管基底层,包裹小直径微血管,如毛细血管前小动脉、毛细血管和毛细血管后小静脉。周细胞参与新生血管是通过内皮细胞和细胞外基质(ECM)的多种信号控制的,包括PDGF-BB和SPARC。成熟周细胞通过表达VEGFR1来接收内皮细胞分泌的VEGF信号来调节血管生成,从而诱导内皮细胞出现茎表型并导致出芽方式的血管延长。对成年小鼠的研究表明,周细胞数量的减少会导致出血和毛细血管过度扩张,并与糖尿病视网膜病变和癌症等疾病相关。
当然,也有专家观点认为周细胞就是间充质干细胞(MSC)。MSC可以从每个血管化的组织中分离出来,甚至可以从月经中分离出来(即破碎的血管释放血管周围的细胞)。脂肪组织的周细胞和脂肪来源的MSC具有相似的基因谱。
(3)血管平滑肌细胞
在血管结构层次(动脉和静脉、小动脉和小静脉)中,血管平滑肌细胞(vSMC)是主要的血管周的壁细胞类型。血管平滑肌细胞呈梭形,通过细胞内丰富的αSMA来控制细胞的收缩功能,从而调节局部血压。内皮细胞通过PDGF-BB信号与血管平滑肌细胞上的受体结合来吸引和黏附(招募)血管平滑肌细胞和周细胞。周细胞和血管平滑肌细胞分泌ANG1,激活内皮细胞表面的Tie-2受体,通过加强内皮细胞细胞间的相互作用来稳定血管;如果Tie受体出现突变,那么可以导致斑块状血管平滑肌细胞覆盖和血管畸形,从而破坏血管的稳定性。
(4)其他细胞类型
除了周细胞和血管平滑肌细胞外,还有一些其他类型的细胞对内皮细胞起支持作用,如成纤维细胞、中性粒细胞和巨噬细胞。在小鼠下肢缺血的实验模型中,缺血周边局部组织有多个明显不同的成纤维细胞亚群(转录谱不同),而这些成纤维细胞亚群的存在有助于血管生成反应,而且还需要依赖于天然免疫信号的激活,才能有助于恢复缺血组织的灌注和恢复。
4,血管病变的MSC治疗
MSC通过分泌一些有功效的物质对受损组织发挥修复作用,或激活受损组织本身的干/祖细胞的激活和分化,即旁分泌作用机制,而不是MSC植入受损组织进行分化为组织细胞。
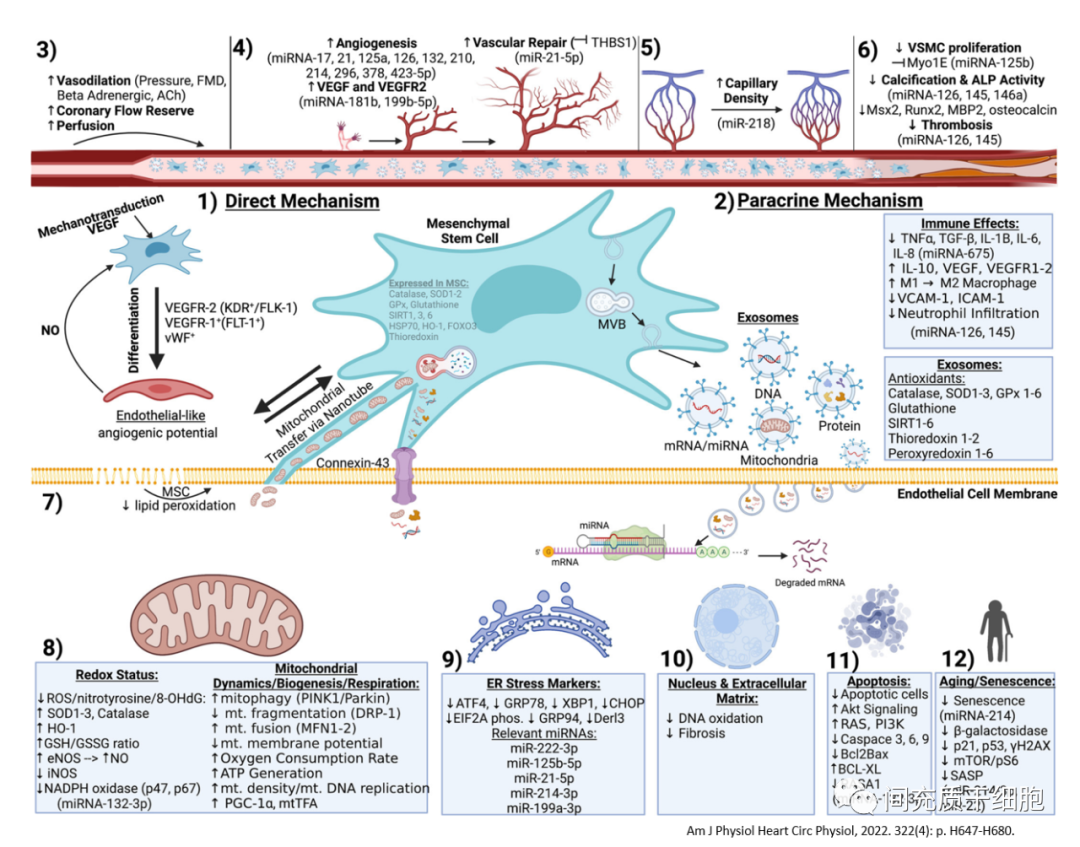
(1)MSC的外泌体机制
MSC外泌体也可用于修复血管屏障功能,从而有利于治疗血管屏障障碍相关的疾病。在MSC外泌体的内含物中,miRNAs是非常重要的具有细胞生物学活性的作用物质之一。MiRNAs可作为基因表达的抑制子,与特定mRNA的3′-非翻译(3′-UTR)区域结合,可通过促进mRNA降解或抑制mRNA翻译为蛋白质,在共同途径内同时调节多个基因。

MSC分泌的外泌体中,同时存在促进血管生成的miRNAs和抑制血管生成的miRNAs,不过抑制血管生成的miRNAs含量很低。比如,miR-93通过作用于多个调节基因,增强内皮细胞增殖和减少骨骼肌细胞凋亡,从而促进后肢缺血后的毛细血管密度和灌注恢复。外泌体所含的miR-125a可通过靶向抑制delta-like 4(DLL4)的表达,从而解除了delta-like 4对血管生成的抑制作用,进而促进内皮细胞的血管生成。又如,miR-15a和miR-503同样为内皮细胞增殖和血管生成的负性调节因子。miR-92a和miR-100靶向对应于几种促血管生成蛋白的mRNAs,在肢体缺血和心肌梗死的小鼠模型中,抑制miR-19、miR-92a和miR-100的活性可促进血管生长和受损组织的功能恢复。抑制可改善老龄小鼠缺血后的血流恢复,并减少对这些靶点的抑制。
一项全面系统研究分析了从人骨髓MSC分离的外泌体中所含的miRNAs,并确定了这些miRNAs调控的主要生物学过程和途径;大约有23个miRNA是以心血管和血管生成过程相关的基因为靶点(90多个与血管和管发育相关的基因被miR-23a-3p、miR-424-5p、miR-144和miR-130a-3p靶向;其余的miRNA以9到85个其他心血管发育、血管生成和管形成基因为靶点);对这些外泌体的功能测试表明,MSC外泌体能够保护心肌细胞免于凋亡,并增加脐带静脉内皮细胞的血管生成。
外泌体也可合成用作药物/基因治疗运载工具,由于其大小而提高生物利用度,并有可能通过靶向其膜上的小分子肽归巢到疾病局部的位置。从药学角度来看,外泌体治疗的主要缺点是细胞分泌外泌体的产量低,分离方法繁琐,并难于确保外泌体含量的批次一致性。需要探索可能更适合大规模外泌体生产的替代方法,并需要验证其在各种干细胞来源和疾病的临床应用。目前,表面标记的评估是为了确保批次一致性,但这仍然不能完全确保外泌体里面内容物在不同批次间的可接受的一致性。
(2)MSC的抗氧化作用
MSC介导的血管再生的一个主要因素是宿主组织的抗氧化作用。MSC对氧化应激具有高度抵抗力,因为它们组成性地表达过氧化氢酶、超氧化物歧化酶1-3(SOD1-3)、谷胱甘肽过氧化物酶(GPx)、SIRT 1/3/6,以及硫氧还蛋白、血红素加氧酶-1,谷胱甘肽(GSH)。这些抗氧化物质通过降低氧化应激、减少炎症以及增加宿主内皮细胞/血管平滑肌细胞抗氧化蛋白含量和/或活性,介导血管损伤和疾病的恢复。
米托坦普尔是一种线粒体ROS清除剂,用于预处理功能失调的糖尿病小鼠脂肪MSC,与对照组(非糖尿病)脂肪MSC相似,在严重肢体缺血的糖尿病小鼠中增加其存活率、分化潜能、迁移和促血管生成。抗氧化剂celastrol预处理与可注射水凝胶支架相结合,可提高大鼠和人骨髓MSC存活率、VEGFA和SDF-1a表达,并增加新生血管密度。
(3)MSC的细胞因子的作用
在MSC的培养上清中,MSC分泌多种可溶性因子-包括VEGF、VEGFR2、Ang-1/Tie2、单核细胞趋化蛋白-1(MCP-1)、巨噬细胞炎性蛋白-1α(MIP-1α)、MIP-1β、单因子、碱性成纤维细胞生长因子(bFGF)、PDGF、IL-1β、IL-10、干细胞衍生因子(SDF)-1、肝细胞生长因子(HGF)、胰岛素样生长因子1(IGF-1)、胸腺肽-β4、Wnt5a 等。
对28项3D培养MSC研究的meta分析显示,截至2019年4月,其中9项研究(7项体外研究和4项体内研究)的骨髓、脂肪和脐血MSC来源的血管生成潜力增强,MSC的3D培养促进VEGFA、VEGFB、HGF、纤维连接蛋白、层粘连蛋白、纤维蛋白原、MMP-1、MMP-2、TGFβ1、bFGF、SDF-1a、HIF-1a、PDGFa和PDGFb等的高表达[85]。
与对照组相比,从人脂肪MSC分离的外泌体(主要因子成分为EGF、bFGF和HGF)增加了体内小鼠伤口真皮的血管化肉芽组织和内皮细胞密度,从而加速伤口收缩,而这三个生长因子对伤口收缩的刺激作用是通过上调PI3K/Akt或FAK/ERK1/2活性实现的。一项比较研究检测了从骨髓MSC、脂肪MSC和脐血MSC分离的外泌体对大鼠心梗的治疗作用,均可以通过增加VEGF、bFGF和HGF刺激血管生成,并增加微血管密度,其中AD-MSCs的作用最为显著。
在一项猪实验研究中,与健康的骨髓MSC相比,动脉粥样硬化性肾动脉狭窄(ARAS)猪的骨髓MSC 表达VEGF水平和血管生成能力降低,细胞衰老率增加[88]。这项研究提示自体骨髓MSC很可能不是干细胞治疗的最佳选择。
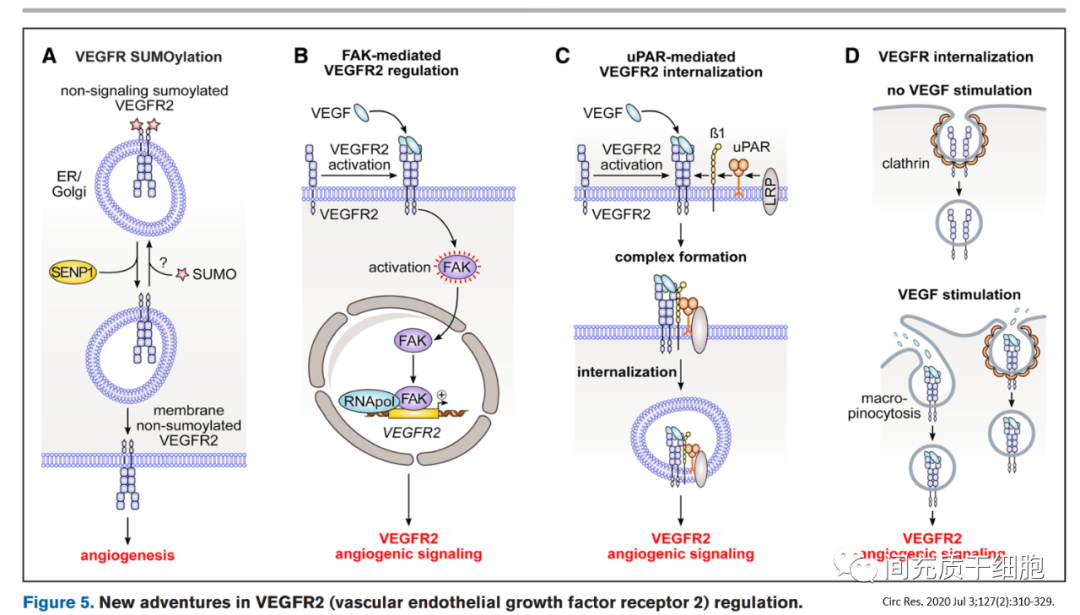
在缺氧和血清饥饿状态下,向内皮细胞中添加VEGF165a可通过减少细胞死亡和增加内皮细胞增殖以及增加糖酵解来诱导血管生成,但存在血管通透性和血管渗漏的现象。而且人体临床研究使用VEGF165a等药物促进缺血区域血管生长以重建血供的治疗效果不佳。
(4)其他机制
MSC来源的外泌体能改善受损细胞的线粒体功能,减少线粒体DNA的损伤和提高线粒体NDA的稳定性。甚至在内皮细胞发生缺血/再灌注损伤的实验中,可以观察到MSC的线粒体可以直接从隧道纳米管转移给内皮细胞,增加内皮细胞产生更多的能量ATP,从而挽救损伤的内皮细胞。在脂多糖诱导的急性肺损伤模型中,肺泡上皮细胞活性氧增加、线粒体膜电位降低和ATP产生降低,肺部血管屏障功能减弱;MSC与肺泡上皮形成了含有连接蛋白43(Cx43)的缝隙连接通道,释放出被上皮细胞吞噬的含有线粒体的外囊泡(外泌体),线粒体从MSC转移到肺泡上皮细胞导致肺泡ATP浓度增加,减少了LPS诱导的急性肺损伤炎症。
在一项研究中,相比于单独使用MSC或脐带静脉内皮细胞,这两种细胞结合水凝胶被注射到小鼠梗死的心脏组织中,移植后4周形成更高毛细血管密度的血管网络,从而促进更多的心肌存活和减少瘢痕区域,显著改善心脏功能,并最终恢复心脏功能。内皮集落形成细胞(ECFC)联合MSC形成周细胞覆盖的灌流血管,而内皮集落形成细胞单独注射到小鼠体内不会形成灌流血管。总的来说,MSC的促血管生成功能已在许多临床前和临床缺血研究中得到证实。
5,小结
MSC治疗也可以在高血压和外周阻力增加的情况下促进微血管再生。比如在慢性肾动脉狭窄大鼠模型中,MSC治疗促进血管紧张素2型受体表达增加、恢复狭窄肾脏的微血管树状网络结构,从而提高肾小球滤过率和肾血浆流量。MSC能恢复肝脏微血管功能和降低门静脉高压力。然而,自体干细胞疗法的持续给药受到患者可获取数量的限制,以及捐赠或接受细胞疗法的患者是否存在可能影响细胞疗法的病理状况。
诸多动物实验的结果证明MSC治疗有助于血管的重建,但是MSC临床研究的结果却并不显著。MSC临床治疗效果不佳的原因有很多,尤其是治疗方案没有经过优化,基本上是单次MSC治疗。至今,终于有美国的干细胞专家(Amanda Jo LeBlanc,University of Louisville)意识到“一次细胞注射就足以提供终身治疗的想法是天真的”。(However, it is naive to think that one administration of cells is enough to provide life-long therapeutic remedy.)

简而言之,在基于细胞的再生医学中,想在体内重建成熟的具有功能的网状结构血管,仍然是有待突破的科学难题。单细胞表观基因组学和转录组学的检测技术有可能分析细胞随时间变化的轨迹,这无疑将有助于确定血管再生过程中血管成熟的关键细胞生物学变化。相信随着对血管再生各个环节的深刻理解,借助于MSC和多种细胞的相互作用,将来是可以完美地解决血管生成的难题。
复制本文链接 文章为作者独立观点不代表本网站立场,未经允许不得转载。

 京公网安备
11010802036058号
京公网安备
11010802036058号
评论